การแนะนำ
อะตอมซึ่งแต่เดิมคิดว่าแบ่งแยกไม่ได้เป็นระบบที่ซับซ้อน พวกมันมีนิวเคลียสขนาดใหญ่ของโปรตอนและนิวตรอน ซึ่งอิเล็กตรอนเคลื่อนที่ไปในอวกาศว่าง อะตอมมีขนาดเล็กมาก ขนาดของพวกมันอยู่ที่ประมาณ 10 –10 –10 –9 เมตร และขนาดของนิวเคลียสยังคงเล็กกว่าประมาณ 100,000 เท่า (10 –15 –10 –14 เมตร) ดังนั้น จึงสามารถ "มองเห็น" อะตอมโดยอ้อมได้ในภาพที่มีกำลังขยายสูงมากเท่านั้น (เช่น การใช้เครื่องฉายภาพแบบปล่อยสนามแม่เหล็ก) แต่ในกรณีนี้ก็ไม่สามารถมองเห็นอะตอมได้อย่างละเอียด ความรู้ของเราเกี่ยวกับโครงสร้างภายในนั้นขึ้นอยู่กับข้อมูลการทดลองจำนวนมหาศาล ซึ่งสนับสนุนข้อมูลข้างต้นโดยทางอ้อมแต่ก็น่าเชื่อถือ แนวคิดเกี่ยวกับโครงสร้างของอะตอมเปลี่ยนแปลงไปอย่างสิ้นเชิงในศตวรรษที่ 20 ได้รับอิทธิพลจากแนวคิดทางทฤษฎีและข้อมูลการทดลองใหม่ๆ ยังคงมีคำถามที่ยังไม่ได้รับการแก้ไขในการอธิบายโครงสร้างภายในของนิวเคลียสของอะตอมซึ่งเป็นหัวข้อของการวิจัยอย่างเข้มข้น ส่วนต่อไปนี้จะสรุปประวัติความเป็นมาของการพัฒนาแนวคิดเกี่ยวกับโครงสร้างของอะตอมโดยรวม บทความแยกต่างหากเกี่ยวกับโครงสร้างของนิวเคลียส (โครงสร้างนิวเคลียสของอะตอม) เนื่องจากแนวคิดเหล่านี้พัฒนาขึ้นโดยอิสระเป็นส่วนใหญ่ พลังงานที่จำเป็นในการศึกษาเปลือกนอกของอะตอมมีขนาดค่อนข้างเล็ก ตามลำดับของพลังงานความร้อนหรือพลังงานเคมี ด้วยเหตุนี้ อิเล็กตรอนจึงถูกค้นพบโดยการทดลองเป็นเวลานานก่อนการค้นพบนิวเคลียส นิวเคลียสแม้จะมีขนาดเล็ก แต่ก็มีการผูกมัดอย่างแน่นหนาดังนั้นจึงสามารถถูกทำลายและศึกษาได้ด้วยความช่วยเหลือของกองกำลังที่รุนแรงกว่าแรงที่กระทำระหว่างอะตอมหลายล้านเท่าเท่านั้น ความก้าวหน้าอย่างรวดเร็วในการทำความเข้าใจโครงสร้างภายในของนิวเคลียสเริ่มต้นเมื่อมีการกำเนิดเครื่องเร่งอนุภาคเท่านั้น ขนาดและพลังงานยึดเหนี่ยวที่แตกต่างกันอย่างมากนี้ทำให้พิจารณาโครงสร้างของอะตอมโดยรวมแยกจากโครงสร้างของนิวเคลียส หากต้องการทราบขนาดของอะตอมและพื้นที่ว่างที่อะตอมครอบครอง ให้พิจารณาอะตอมที่ประกอบเป็นหยดน้ำที่มีเส้นผ่านศูนย์กลาง 1 มม. หากคุณขยายการหยดนี้ให้มีขนาดเท่ากับโลกทางจิตใจอะตอมของไฮโดรเจนและออกซิเจนที่รวมอยู่ในโมเลกุลของน้ำจะมีเส้นผ่านศูนย์กลาง 1-2 ม. มวลส่วนใหญ่ของแต่ละอะตอมจะกระจุกตัวอยู่ที่แกนกลางเส้นผ่านศูนย์กลาง ซึ่งมีความบางเพียง 0.01 มม.
ส่วนสำคัญ
ฉัน. วิวัฒนาการของความคิดเกี่ยวกับโครงสร้างของอะตอม
การค้นพบโครงสร้างที่ซับซ้อนของอะตอมเป็นขั้นตอนที่สำคัญที่สุดในการพัฒนาฟิสิกส์สมัยใหม่ ในกระบวนการสร้างทฤษฎีเชิงปริมาณของโครงสร้างอะตอม ซึ่งทำให้สามารถอธิบายระบบอะตอมได้ แนวคิดใหม่ๆ เกิดขึ้นเกี่ยวกับคุณสมบัติของอนุภาคขนาดเล็ก ซึ่งอธิบายโดยกลศาสตร์ควอนตัม
ความคิดที่ว่าอะตอมเป็นอนุภาคที่เล็กที่สุดของสารที่แบ่งแยกไม่ได้ดังที่กล่าวไว้ข้างต้นเกิดขึ้นในสมัยโบราณ (Democritus, Epicurus, Lucretius) ในยุคกลาง หลักคำสอนเรื่องอะตอมซึ่งเป็นวัตถุนิยมไม่ได้รับการยอมรับ เมื่อต้นศตวรรษที่ 18 ทฤษฎีอะตอมกำลังได้รับความนิยมเพิ่มมากขึ้น มาถึงตอนนี้ผลงานของนักเคมีชาวฝรั่งเศส A. Lavoisier (1743–1794) นักวิทยาศาสตร์ชาวรัสเซียผู้ยิ่งใหญ่ M.V. Lomonosov และนักเคมีและนักฟิสิกส์ชาวอังกฤษ D. Dalton (1766–1844) พิสูจน์ความเป็นจริงของการมีอยู่ของอะตอม อย่างไรก็ตามในเวลานี้คำถามเกี่ยวกับโครงสร้างภายในของอะตอมไม่ได้เกิดขึ้นเนื่องจากอะตอมถือว่าแบ่งแยกไม่ได้
มีบทบาทสำคัญในการพัฒนาทฤษฎีอะตอมโดยนักเคมีชาวรัสเซียชื่อ D.I. Mendeleev ซึ่งในปีพ. ศ. 2412 ได้พัฒนาระบบธาตุซึ่งเป็นครั้งแรกที่มีการหยิบยกคำถามเกี่ยวกับธรรมชาติของอะตอมที่เป็นหนึ่งเดียวบนพื้นฐานทางวิทยาศาสตร์ ในช่วงครึ่งหลังของศตวรรษที่ 19 ได้รับการพิสูจน์จากการทดลองแล้วว่าอิเล็กตรอนเป็นหนึ่งในส่วนหลักของสารใดๆ ข้อสรุปเหล่านี้ตลอดจนข้อมูลการทดลองจำนวนมากนำไปสู่ความจริงที่ว่าเมื่อต้นศตวรรษที่ 20 คำถามเกี่ยวกับโครงสร้างของอะตอมเกิดขึ้นอย่างจริงจัง
การมีอยู่ของการเชื่อมโยงตามธรรมชาติระหว่างองค์ประกอบทางเคมีทั้งหมด ซึ่งแสดงให้เห็นอย่างชัดเจนในระบบคาบของเมนเดเลเยฟ แสดงให้เห็นว่าโครงสร้างของอะตอมทั้งหมดนั้นมีพื้นฐานอยู่บนคุณสมบัติร่วมกัน: พวกมันทั้งหมดมีความสัมพันธ์กันอย่างใกล้ชิด
อย่างไรก็ตามจนถึงปลายศตวรรษที่ 19 ในวิชาเคมี ความเชื่อมั่นทางอภิปรัชญามีชัยว่าอะตอมเป็นอนุภาคที่เล็กที่สุดของสสารเชิงเดี่ยว ซึ่งเป็นขีดจำกัดสุดท้ายของการแบ่งแยกสสาร ในระหว่างการเปลี่ยนแปลงทางเคมีทั้งหมด มีเพียงโมเลกุลเท่านั้นที่ถูกทำลายและสร้างขึ้นใหม่ ในขณะที่อะตอมยังคงไม่เปลี่ยนแปลงและไม่สามารถแบ่งออกเป็นส่วนเล็กๆ ได้
เป็นเวลานานแล้วที่สมมติฐานต่างๆ เกี่ยวกับโครงสร้างของอะตอมไม่ได้รับการยืนยันจากข้อมูลการทดลองใดๆ เฉพาะช่วงปลายศตวรรษที่ 19 เท่านั้น มีการค้นพบที่แสดงให้เห็นถึงความซับซ้อนของโครงสร้างของอะตอมและความเป็นไปได้ในการเปลี่ยนอะตอมบางอะตอมให้เป็นอะตอมอื่นภายใต้เงื่อนไขบางประการ จากการค้นพบเหล่านี้ หลักคำสอนเรื่องโครงสร้างของอะตอมเริ่มพัฒนาอย่างรวดเร็ว
หลักฐานทางอ้อมประการแรกของโครงสร้างที่ซับซ้อนของอะตอมได้มาจากการศึกษารังสีแคโทดที่เกิดขึ้นระหว่างการปล่อยกระแสไฟฟ้าในก๊าซที่ทำให้บริสุทธิ์สูง การศึกษาคุณสมบัติของรังสีเหล่านี้นำไปสู่ข้อสรุปว่าพวกมันคือกระแสของอนุภาคขนาดเล็กที่มีประจุไฟฟ้าลบและบินด้วยความเร็วใกล้เคียงกับความเร็วแสง ด้วยการใช้เทคนิคพิเศษ มันเป็นไปได้ที่จะกำหนดมวลของอนุภาคแคโทดและขนาดของประจุ และพบว่าพวกมันไม่ได้ขึ้นอยู่กับลักษณะของก๊าซที่เหลืออยู่ในหลอดหรือกับสารที่อิเล็กโทรด ถูกสร้างขึ้นหรือในเงื่อนไขการทดลองอื่น ๆ นอกจากนี้ อนุภาคแคโทดยังเป็นที่รู้จักในสถานะมีประจุเท่านั้น และไม่สามารถแยกประจุออกและแปลงเป็นอนุภาคที่เป็นกลางทางไฟฟ้าได้ ประจุไฟฟ้าคือสาระสำคัญของธรรมชาติ อนุภาคเหล่านี้เรียกว่าอิเล็กตรอน ถูกค้นพบในปี พ.ศ. 2440 โดยนักฟิสิกส์ชาวอังกฤษ เจ. ทอมสัน
การศึกษาโครงสร้างของอะตอมในทางปฏิบัติเริ่มขึ้นในปี พ.ศ. 2440-2441 หลังจากธรรมชาติของรังสีแคโทดในขณะที่กระแสอิเล็กตรอนถูกสร้างขึ้นในที่สุด และประจุและมวลของอิเล็กตรอนก็ถูกกำหนดไว้ ทอมสันเสนอแบบจำลองแรกของอะตอม โดยนำเสนออะตอมเป็นกลุ่มของสสารที่มีประจุไฟฟ้าบวก ซึ่งมีอิเล็กตรอนจำนวนมากกระจายตัวกันจนกลายเป็นรูปแบบที่เป็นกลางทางไฟฟ้า ในแบบจำลองนี้ สันนิษฐานว่าภายใต้อิทธิพลของอิทธิพลภายนอก อิเล็กตรอนสามารถแกว่งได้ กล่าวคือ เคลื่อนที่ด้วยอัตราเร่ง ดูเหมือนว่าสิ่งนี้ทำให้สามารถตอบคำถามเกี่ยวกับการเปล่งแสงโดยอะตอมของสสารและรังสีแกมมาโดยอะตอมของสารกัมมันตภาพรังสี
แบบจำลองอะตอมของทอมสันไม่ได้ถือว่าอนุภาคที่มีประจุบวกอยู่ภายในอะตอม แต่แล้วเราจะอธิบายการปล่อยอนุภาคอัลฟาที่มีประจุบวกจากสารกัมมันตภาพรังสีได้อย่างไร? แบบจำลองอะตอมของทอมสันไม่ได้ตอบคำถามอื่นๆ
ในปี 1911 นักฟิสิกส์ชาวอังกฤษ อี. รัทเธอร์ฟอร์ด ขณะศึกษาการเคลื่อนที่ของอนุภาคแอลฟาในก๊าซและสารอื่นๆ ค้นพบส่วนหนึ่งของอะตอมที่มีประจุบวก การศึกษาอย่างละเอียดเพิ่มเติมแสดงให้เห็นว่าเมื่อลำแสงรังสีคู่ขนานผ่านชั้นของก๊าซหรือแผ่นโลหะบาง ๆ รังสีคู่ขนานจะไม่เกิดขึ้นอีกต่อไป แต่จะแยกออกไปบ้าง: อนุภาคอัลฟากระจัดกระจาย กล่าวคือ พวกมันเบี่ยงเบนไปจากเส้นทางดั้งเดิม มุมโก่งมีขนาดเล็ก แต่ก็มีอนุภาคจำนวนเล็กน้อย (ประมาณหนึ่งในหลายพัน) เสมอที่โก่งตัวอย่างรุนแรง อนุภาคบางส่วนถูกโยนกลับราวกับว่าพวกมันเจอกับสิ่งกีดขวางที่ผ่านเข้าไปไม่ได้ สิ่งเหล่านี้ไม่ใช่อิเล็กตรอน - มวลของพวกมันน้อยกว่ามวลอนุภาคอัลฟ่ามาก การโก่งตัวสามารถเกิดขึ้นได้เมื่อชนกับอนุภาคบวกซึ่งมีมวลอยู่ในลำดับเดียวกันกับมวลของอนุภาคแอลฟา จากการพิจารณาเหล่านี้ รัทเทอร์ฟอร์ดได้เสนอแผนภาพโครงสร้างของอะตอมดังต่อไปนี้
ที่ใจกลางอะตอมจะมีนิวเคลียสที่มีประจุบวก ซึ่งอิเล็กตรอนจะหมุนไปในวงโคจรที่แตกต่างกัน แรงเหวี่ยงที่เกิดขึ้นระหว่างการหมุนนั้นสมดุลกันด้วยแรงดึงดูดระหว่างนิวเคลียสและอิเล็กตรอน ซึ่งส่งผลให้พวกมันยังคงอยู่ในระยะที่กำหนดจากนิวเคลียส เนื่องจากมวลของอิเล็กตรอนมีค่าเล็กน้อย มวลเกือบทั้งหมดของอะตอมจึงมีความเข้มข้นในนิวเคลียสของมัน ส่วนแบ่งของนิวเคลียสและอิเล็กตรอนซึ่งมีจำนวนค่อนข้างน้อยนั้นเป็นเพียงส่วนไม่มีนัยสำคัญของพื้นที่ทั้งหมดที่ถูกครอบครองโดยระบบอะตอม
แผนภาพโครงสร้างของอะตอมที่เสนอโดยรัทเทอร์ฟอร์ดหรือตามที่พวกเขามักพูดว่าแบบจำลองดาวเคราะห์ของอะตอมอธิบายปรากฏการณ์การโก่งตัวของอนุภาคอัลฟ่าได้อย่างง่ายดาย แท้จริงแล้ว ขนาดของนิวเคลียสและอิเล็กตรอนนั้นเล็กมากเมื่อเทียบกับขนาดของอะตอมทั้งหมด ซึ่งถูกกำหนดโดยวงโคจรของอิเล็กตรอนที่อยู่ห่างจากนิวเคลียสมากที่สุด ดังนั้นอนุภาคอัลฟาส่วนใหญ่จะบินผ่านอะตอมโดยไม่มีการโก่งตัวที่เห็นได้ชัดเจน เฉพาะในกรณีที่อนุภาคอัลฟาเข้ามาใกล้นิวเคลียสมากเท่านั้น แรงผลักทางไฟฟ้าทำให้มันเบี่ยงเบนไปจากเส้นทางเดิมอย่างรวดเร็ว ดังนั้น การศึกษาการกระเจิงของอนุภาคอัลฟาจึงเป็นรากฐานของทฤษฎีนิวเคลียร์ของอะตอม
ครั้งที่สอง สมมุติฐานของบอร์
แบบจำลองดาวเคราะห์ของอะตอมทำให้สามารถอธิบายผลการทดลองเกี่ยวกับการกระเจิงของอนุภาคอัลฟ่าของสสารได้ แต่ปัญหาพื้นฐานเกิดขึ้นในการพิสูจน์ความเสถียรของอะตอม ความพยายามครั้งแรกในการสร้างทฤษฎีอะตอมควอนตัมเชิงคุณภาพใหม่เกิดขึ้นในปี พ.ศ. 2456 โดยนีลส์ บอร์ เขาตั้งเป้าหมายในการเชื่อมโยงกฎเชิงประจักษ์ของสเปกตรัมเส้นตรง แบบจำลองนิวเคลียร์ของอะตอมของรัทเทอร์ฟอร์ด และธรรมชาติของควอนตัมของการแผ่รังสีและการดูดกลืนแสงให้เป็นหนึ่งเดียว Bohr ใช้ทฤษฎีของเขากับแบบจำลองนิวเคลียร์ของรัทเทอร์ฟอร์ด เขาแนะนำว่าอิเล็กตรอนเคลื่อนที่ไปรอบนิวเคลียสในวงโคจรเป็นวงกลม การเคลื่อนที่แบบวงกลมแม้จะมีความเร็วคงที่ แต่ก็มีความเร่ง การเคลื่อนที่ของประจุด้วยความเร่งนี้เทียบเท่ากับกระแสสลับ ซึ่งสร้างสนามแม่เหล็กไฟฟ้ากระแสสลับในอวกาศ พลังงานถูกใช้เพื่อสร้างสนามนี้ พลังงานสนามสามารถสร้างขึ้นได้เนื่องจากพลังงานของปฏิกิริยาคูลอมบ์ของอิเล็กตรอนกับนิวเคลียส เป็นผลให้อิเล็กตรอนจะต้องเคลื่อนที่เป็นเกลียวและตกสู่นิวเคลียส อย่างไรก็ตาม จากประสบการณ์แสดงให้เห็นว่าอะตอมมีการก่อตัวที่เสถียรมาก จากนี้ไปผลลัพธ์ของพลศาสตร์ไฟฟ้าแบบคลาสสิกซึ่งอิงตามสมการของแมกซ์เวลล์ ไม่สามารถใช้ได้กับกระบวนการภายในอะตอม จำเป็นต้องหารูปแบบใหม่ๆ บอร์ยึดทฤษฎีอะตอมของเขาตามสมมุติฐานต่อไปนี้
สมมุติฐานข้อแรกของบอร์(สมมุติฐานของสถานะคงที่): ในอะตอมมีสถานะคงที่ (ไม่เปลี่ยนแปลงตามเวลา) โดยที่อะตอมไม่ปล่อยพลังงานออกมา สถานะคงที่ของอะตอมสอดคล้องกับวงโคจรที่อยู่นิ่งตามที่อิเล็กตรอนเคลื่อนที่ การเคลื่อนที่ของอิเล็กตรอนในวงโคจรที่อยู่นิ่งไม่ได้มาพร้อมกับการปล่อยคลื่นแม่เหล็กไฟฟ้าสมมุติฐานนี้ขัดแย้งกับทฤษฎีคลาสสิก ในสถานะคงที่ของอะตอม อิเล็กตรอนที่เคลื่อนที่ในวงโคจรเป็นวงกลม จะต้องมีค่าควอนตัมแยกกันของโมเมนตัมเชิงมุม
สมมุติฐานที่สองของบอร์(กฎความถี่): เมื่ออิเล็กตรอนเคลื่อนที่จากวงโคจรที่อยู่นิ่งหนึ่งไปยังอีกวงหนึ่ง โฟตอนหนึ่งที่มีพลังงานจะถูกปล่อยออกมา (ถูกดูดซับ)
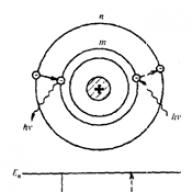
เท่ากับความแตกต่างระหว่างพลังงานของสถานะคงที่ที่สอดคล้องกัน (En และ Em คือพลังงานของสถานะคงที่ของอะตอมตามลำดับก่อนและหลังการแผ่รังสี/การดูดซึม)การเปลี่ยนผ่านของอิเล็กตรอนจากวงโคจรที่อยู่กับที่หมายเลข m ไปเป็นหมายเลขวงโคจรที่อยู่กับที่ nสอดคล้องกับการเปลี่ยนแปลงของอะตอมจากสถานะที่มีพลังงาน เอมเข้าสู่สภาวะที่มีพลังงาน En (รูปที่ 1) 
รูปที่ 1. เพื่ออธิบายสมมุติฐานของบอร์
рEn>การปล่อยโฟตอนของ Em เกิดขึ้น (การเปลี่ยนแปลงของอะตอมจากสถานะที่มีพลังงานสูงกว่าไปสู่สถานะที่มีพลังงานต่ำกว่า เช่น การเปลี่ยนของอิเล็กตรอนจากวงโคจรที่ห่างไกลจากนิวเคลียสไปสู่สถานะที่ใกล้กว่า) ที่ En<Еm – его поглощение (переход атома в состояние с большей энергией, т. е, переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот ![]() การเปลี่ยนผ่านควอนตัมและกำหนดสเปกตรัมเส้นตรงของอะตอม ทฤษฎีของบอร์อธิบายสเปกตรัมเส้นสเปกตรัมของไฮโดรเจนที่สังเกตได้จากการทดลองได้อย่างชาญฉลาด ความสำเร็จของทฤษฎีอะตอมไฮโดรเจนเกิดขึ้นได้ด้วยการละทิ้งหลักการพื้นฐานของกลศาสตร์คลาสสิก ซึ่งยังคงใช้ได้โดยไม่มีเงื่อนไขมานานกว่า 200 ปี ดังนั้นการพิสูจน์การทดลองโดยตรงเกี่ยวกับความถูกต้องของสมมุติฐานของบอร์ โดยเฉพาะอย่างยิ่งข้อแรกเกี่ยวกับการดำรงอยู่ของสภาวะคงที่จึงมีความสำคัญอย่างยิ่ง สมมุติฐานที่สองถือได้ว่าเป็นผลมาจากกฎการอนุรักษ์พลังงานและสมมติฐานเกี่ยวกับการดำรงอยู่ของโฟตอน นักฟิสิกส์ชาวเยอรมัน D. Frank และ G. Hertz ศึกษาการชนกันของอิเล็กตรอนกับอะตอมของก๊าซโดยใช้วิธีศักย์ไฟฟ้าชะลอ (1913) ยืนยันการทดลองว่ามีสถานะคงที่และความไม่ต่อเนื่องของค่าพลังงานปรมาณู แม้ว่าแนวคิดของ Bohr จะประสบความสำเร็จอย่างไม่ต้องสงสัยเกี่ยวกับอะตอมไฮโดรเจนซึ่งเป็นไปได้ที่จะสร้างทฤษฎีเชิงปริมาณของสเปกตรัม แต่ก็ไม่สามารถสร้างทฤษฎีที่คล้ายกันสำหรับอะตอมฮีเลียมถัดจากไฮโดรเจนได้ ถึงแนวคิดของบอร์ เกี่ยวกับอะตอมฮีเลียมและอะตอมที่ซับซ้อนมากขึ้น ทฤษฎีของบอร์ทำให้เราสามารถสรุปได้เฉพาะข้อสรุปเชิงคุณภาพ (แม้ว่าจะสำคัญมาก) เท่านั้น ความคิดเกี่ยวกับวงโคจรบางอย่างที่อิเล็กตรอนเคลื่อนที่ในอะตอมของบอร์กลายเป็นว่ามีเงื่อนไขมาก ที่จริงแล้ว การเคลื่อนที่ของอิเล็กตรอนในอะตอมมีความเหมือนกันเพียงเล็กน้อยกับการเคลื่อนที่ของดาวเคราะห์ในวงโคจร ในปัจจุบัน ด้วยความช่วยเหลือของกลศาสตร์ควอนตัม จึงเป็นไปได้ที่จะตอบคำถามมากมายเกี่ยวกับโครงสร้างและคุณสมบัติของอะตอมขององค์ประกอบใดๆ
การเปลี่ยนผ่านควอนตัมและกำหนดสเปกตรัมเส้นตรงของอะตอม ทฤษฎีของบอร์อธิบายสเปกตรัมเส้นสเปกตรัมของไฮโดรเจนที่สังเกตได้จากการทดลองได้อย่างชาญฉลาด ความสำเร็จของทฤษฎีอะตอมไฮโดรเจนเกิดขึ้นได้ด้วยการละทิ้งหลักการพื้นฐานของกลศาสตร์คลาสสิก ซึ่งยังคงใช้ได้โดยไม่มีเงื่อนไขมานานกว่า 200 ปี ดังนั้นการพิสูจน์การทดลองโดยตรงเกี่ยวกับความถูกต้องของสมมุติฐานของบอร์ โดยเฉพาะอย่างยิ่งข้อแรกเกี่ยวกับการดำรงอยู่ของสภาวะคงที่จึงมีความสำคัญอย่างยิ่ง สมมุติฐานที่สองถือได้ว่าเป็นผลมาจากกฎการอนุรักษ์พลังงานและสมมติฐานเกี่ยวกับการดำรงอยู่ของโฟตอน นักฟิสิกส์ชาวเยอรมัน D. Frank และ G. Hertz ศึกษาการชนกันของอิเล็กตรอนกับอะตอมของก๊าซโดยใช้วิธีศักย์ไฟฟ้าชะลอ (1913) ยืนยันการทดลองว่ามีสถานะคงที่และความไม่ต่อเนื่องของค่าพลังงานปรมาณู แม้ว่าแนวคิดของ Bohr จะประสบความสำเร็จอย่างไม่ต้องสงสัยเกี่ยวกับอะตอมไฮโดรเจนซึ่งเป็นไปได้ที่จะสร้างทฤษฎีเชิงปริมาณของสเปกตรัม แต่ก็ไม่สามารถสร้างทฤษฎีที่คล้ายกันสำหรับอะตอมฮีเลียมถัดจากไฮโดรเจนได้ ถึงแนวคิดของบอร์ เกี่ยวกับอะตอมฮีเลียมและอะตอมที่ซับซ้อนมากขึ้น ทฤษฎีของบอร์ทำให้เราสามารถสรุปได้เฉพาะข้อสรุปเชิงคุณภาพ (แม้ว่าจะสำคัญมาก) เท่านั้น ความคิดเกี่ยวกับวงโคจรบางอย่างที่อิเล็กตรอนเคลื่อนที่ในอะตอมของบอร์กลายเป็นว่ามีเงื่อนไขมาก ที่จริงแล้ว การเคลื่อนที่ของอิเล็กตรอนในอะตอมมีความเหมือนกันเพียงเล็กน้อยกับการเคลื่อนที่ของดาวเคราะห์ในวงโคจร ในปัจจุบัน ด้วยความช่วยเหลือของกลศาสตร์ควอนตัม จึงเป็นไปได้ที่จะตอบคำถามมากมายเกี่ยวกับโครงสร้างและคุณสมบัติของอะตอมขององค์ประกอบใดๆ
สาม. โครงสร้างของนิวเคลียสของอะตอม
โครงสร้างของนิวเคลียสของอะตอม
ระดับนิวเคลียส
ประมาณ 20 ปีหลังจากที่รัทเทอร์ฟอร์ด “ค้นพบ” นิวเคลียสของมันในส่วนลึกของอะตอม นิวตรอนก็ถูกค้นพบ ซึ่งเป็นอนุภาคในคุณสมบัติทั้งหมดของมันเหมือนกับนิวเคลียสของอะตอมไฮโดรเจน นั่นคือโปรตอน แต่ไม่มีประจุไฟฟ้าเท่านั้น นิวตรอนปรากฏว่าสะดวกอย่างยิ่งในการตรวจวัดภายในนิวเคลียส เนื่องจากมีความเป็นกลางทางไฟฟ้า สนามไฟฟ้าของนิวเคลียสจึงไม่สามารถขับไล่มันได้ ดังนั้น แม้แต่นิวตรอนที่ช้าก็สามารถเข้าใกล้นิวเคลียสได้อย่างง่ายดายในระยะทางที่พลังนิวเคลียร์เริ่มแสดงออกมา หลังจากการค้นพบนิวตรอน ฟิสิกส์ของโลกใบเล็กก็ก้าวไปข้างหน้าอย่างก้าวกระโดด
ไม่นานหลังจากการค้นพบนิวตรอน นักฟิสิกส์เชิงทฤษฎีสองคน ได้แก่ แวร์เนอร์ ไฮเซนเบิร์ก ชาวเยอรมัน และมิทรี อิวาเนนโก แห่งโซเวียต ตั้งสมมติฐานว่านิวเคลียสของอะตอมประกอบด้วยนิวตรอนและโปรตอน ความเข้าใจสมัยใหม่เกี่ยวกับโครงสร้างของนิวเคลียสนั้นขึ้นอยู่กับมัน
โปรตอนและนิวตรอนรวมกันด้วยคำว่านิวคลีออน โปรตอนเป็นอนุภาคมูลฐานที่เป็นนิวเคลียสของอะตอมขององค์ประกอบทางเคมีที่เบาที่สุด - ไฮโดรเจน จำนวนโปรตอนในนิวเคลียสเท่ากับเลขอะตอมขององค์ประกอบในตารางธาตุและถูกกำหนดให้เป็น Z (จำนวนนิวตรอน - N) โปรตอนมีประจุไฟฟ้าบวก ซึ่งเท่ากับค่าสัมบูรณ์ของประจุไฟฟ้าพื้นฐาน มันหนักกว่าอิเล็กตรอนประมาณ 1,836 เท่า โปรตอนประกอบด้วยอัพควาร์กสองตัวที่มีประจุ Q = + 2/3 และ d-ควาร์กหนึ่งตัวที่มี Q = – 1/3 เชื่อมต่อกันด้วยสนามกลูออน มันมีมิติสุดท้ายของลำดับที่ 10-15 เมตร แม้ว่าจะไม่สามารถจินตนาการได้ว่าเป็นลูกบอลแข็ง แต่มันค่อนข้างจะมีลักษณะคล้ายกับเมฆที่มีขอบเขตไม่ชัดเจน ซึ่งประกอบด้วยอนุภาคเสมือนที่สร้างขึ้นและทำลายล้าง
ประจุไฟฟ้าของนิวตรอนคือ 0 และมีมวลประมาณ 940 MeV นิวตรอนประกอบด้วยยูควาร์กหนึ่งตัวและดีควาร์กสองตัว อนุภาคนี้มีความเสถียรเฉพาะในองค์ประกอบของนิวเคลียสของอะตอมที่เสถียรเท่านั้น นิวตรอนอิสระจะสลายตัวเป็นอิเล็กตรอน โปรตอน และแอนตินิวตริโนอิเล็กตรอน ครึ่งชีวิตของนิวตรอน (เวลาที่ครึ่งหนึ่งของจำนวนนิวตรอนเดิมใช้ในการสลายตัว) คือประมาณ 12 นาที ในสสาร นิวตรอนจะอยู่ในรูปแบบอิสระในเวลาที่สั้นลงด้วยซ้ำเนื่องจากการดูดกลืนที่รุนแรงของนิวเคลียส เช่นเดียวกับโปรตอน นิวตรอนมีส่วนร่วมในการโต้ตอบทุกประเภทรวมถึงแม่เหล็กไฟฟ้าด้วย: ด้วยความเป็นกลางทั่วไปเนื่องจากมีโครงสร้างภายในที่ซับซ้อนจึงมีกระแสไฟฟ้าอยู่ในนั้น
ในนิวเคลียส นิวคลีออนจะถูกพันธะด้วยแรงชนิดพิเศษ นั่นคือ นิวเคลียร์ หนึ่งในคุณสมบัติที่เป็นลักษณะเฉพาะของพวกเขาคือการแสดงฤทธิ์สั้น: ที่ระยะห่างประมาณ 10-15 ม. หรือน้อยกว่านั้นจะมีแรงเกินกว่าแรงอื่นใดซึ่งเป็นผลมาจากการที่นิวคลีออนไม่แยกออกจากกันภายใต้อิทธิพลของการขับไล่ไฟฟ้าสถิตของโปรตอนที่มีประจุเหมือนกัน . ในระยะไกล แรงนิวเคลียร์จะลดลงจนเหลือศูนย์อย่างรวดเร็ว
กลไกการออกฤทธิ์ของแรงนิวเคลียร์นั้นใช้หลักการเดียวกับแรงแม่เหล็กไฟฟ้าในการแลกเปลี่ยนวัตถุที่มีปฏิสัมพันธ์กับอนุภาคเสมือน
อนุภาคเสมือนในทฤษฎีควอนตัมคืออนุภาคที่มีเลขควอนตัม (ประจุสปิน ประจุไฟฟ้า และแบริออน ฯลฯ) เท่ากันกับอนุภาคจริงที่สอดคล้องกัน แต่ความสัมพันธ์ปกติระหว่างพลังงาน โมเมนตัม และมวลไม่คงที่
IV. การทดลองของรัทเทอร์ฟอร์ด

ในสนามแม่เหล็ก ฟลักซ์ของรังสีกัมมันตภาพรังสีจะแบ่งออกเป็น 3 องค์ประกอบ ได้แก่ รังสีอัลฟ่า รังสีบีตา และรังสีแกมมา

ปรากฏการณ์กัมมันตภาพรังสีบ่งบอกถึงโครงสร้างที่ซับซ้อนของอะตอม
บทสรุป
โดยสรุป เราได้ข้อสรุปว่าแนวคิดของรัทเธอร์ฟอร์ด-บอร์เป็นมากกว่าอนุภาคของความจริงสัมบูรณ์ แม้ว่าการพัฒนาฟิสิกส์เพิ่มเติมจะเผยให้เห็นข้อผิดพลาดมากมายในแนวคิดนี้ก็ตาม ความรู้ที่ถูกต้องอย่างแน่นอนส่วนใหญ่ยิ่งกว่านั้นก็มีอยู่ในทฤษฎีกลศาสตร์ควอนตัมของอะตอม
การค้นพบโครงสร้างที่ซับซ้อนของอะตอมเป็นเหตุการณ์สำคัญในวิชาฟิสิกส์ เนื่องจากแนวคิดของฟิสิกส์คลาสสิกเกี่ยวกับอะตอมในฐานะหน่วยโครงสร้างของสสารที่เป็นของแข็งและแบ่งแยกไม่ได้ถูกหักล้าง
เลเซอร์
ตามทฤษฎีควอนตัมของการแผ่รังสี เครื่องกำเนิดควอนตัมของคลื่นวิทยุและเครื่องกำเนิดควอนตัมของแสงที่มองเห็นได้ (เลเซอร์) ได้ถูกสร้างขึ้น เลเซอร์ผลิตรังสีที่สอดคล้องกันซึ่งมีกำลังสูงมาก การแผ่รังสีเลเซอร์มีการใช้กันอย่างแพร่หลายในสาขาวิทยาศาสตร์และเทคโนโลยีต่างๆ เช่น สำหรับการสื่อสารในอวกาศ สำหรับการบันทึกและจัดเก็บข้อมูล (ดิสก์เลเซอร์) และการเชื่อมในทางการแพทย์
สเปกตรัม
ทฤษฎีของบอร์ทำให้สามารถอธิบายการมีอยู่ของสเปกตรัมเส้นได้
สูตร (1) ให้แนวคิดเชิงคุณภาพว่าเหตุใดสเปกตรัมการแผ่รังสีและการดูดกลืนแสงของอะตอมจึงเรียงกัน ในความเป็นจริง อะตอมสามารถปล่อยคลื่นได้เฉพาะความถี่ที่สอดคล้องกับค่าพลังงานที่แตกต่างกันเท่านั้น อี 1 , อี 2 , . . . , เอน ,. . นั่นคือสาเหตุที่สเปกตรัมการปล่อยก๊าซของอะตอมประกอบด้วยเส้นสว่างที่คมชัดซึ่งแยกจากกัน ในเวลาเดียวกันอะตอมไม่สามารถดูดซับโฟตอนใด ๆ ได้ แต่มีเพียงโฟตอนที่มีพลังงานเท่านั้น hνซึ่งเท่ากับผลต่างพอดีเลย เอ็น − เอกค่าพลังงานที่อนุญาตสองค่า เอ็นและ เอก. ไปสู่สภาวะพลังงานที่สูงขึ้น เอ็นอะตอมดูดซับโฟตอนเดียวกันกับที่พวกมันสามารถเปล่งออกมาได้ในระหว่างการเปลี่ยนกลับไปสู่สถานะดั้งเดิม เอก. พูดง่ายๆ ก็คือ อะตอมจะดึงเส้นเหล่านั้นที่พวกมันปล่อยออกมาจากสเปกตรัมต่อเนื่อง นี่คือเหตุผลว่าทำไมเส้นสีเข้มของสเปกตรัมการดูดกลืนแสงของก๊าซอะตอมเย็นจึงอยู่ในตำแหน่งที่มีเส้นสว่างของสเปกตรัมการปล่อยก๊าซเดียวกันในสถานะร้อน
สเปกตรัมต่อเนื่อง สเปกตรัมการปล่อยไฮโดรเจน สเปกตรัมการดูดซึมไฮโดรเจน
คำว่า "อะตอม" แปลจากภาษากรีกแปลว่า "แบ่งแยกไม่ได้" เป็นเวลานานจนถึงต้นศตวรรษที่ 20 อะตอมหมายถึงอนุภาคที่เล็กที่สุดของสสารซึ่งแบ่งแยกไม่ได้ เมื่อต้นศตวรรษที่ 20 วิทยาศาสตร์ได้สะสมข้อเท็จจริงมากมายที่บ่งบอกถึงโครงสร้างที่ซับซ้อนของอะตอม
ความก้าวหน้าอย่างมากในการศึกษาโครงสร้างของอะตอมเกิดขึ้นได้ในการทดลองของนักวิทยาศาสตร์ชาวอังกฤษ Ernest Rutherford เกี่ยวกับการกระเจิงของอนุภาคอัลฟ่าเมื่อผ่านชั้นบาง ๆ ของสสาร ในการทดลองเหล่านี้ ลำแสงแคบของอนุภาค α ที่ปล่อยออกมาจากสารกัมมันตภาพรังสีมุ่งเป้าไปที่ฟอยล์สีทองบางๆ ตะแกรงถูกวางไว้ด้านหลังฟอยล์ ซึ่งสามารถเรืองแสงได้ภายใต้การกระแทกของอนุภาคเร็ว พบว่าอนุภาค α ส่วนใหญ่เบี่ยงเบนไปจากการแพร่กระจายเป็นเส้นตรงหลังจากผ่านฟอยล์ กล่าวคือ พวกมันกระจัดกระจาย และโดยทั่วไปอนุภาค α บางส่วนจะถูกโยนกลับ รัทเทอร์ฟอร์ดอธิบายการกระเจิงของอนุภาคαโดยข้อเท็จจริงที่ว่าประจุบวกไม่กระจายอย่างสม่ำเสมอในลูกบอลที่มีรัศมี 10 -10 ม. ตามที่คิดไว้ก่อนหน้านี้ แต่กระจุกตัวอยู่ที่ส่วนกลางของอะตอม - นิวเคลียสของอะตอม เมื่อเคลื่อนผ่านใกล้นิวเคลียส อนุภาคที่มีประจุบวกจะถูกผลักไส และเมื่อมันกระทบนิวเคลียส ก็จะถูกเหวี่ยงกลับไปในทิศทางตรงกันข้าม นี่คือลักษณะการทำงานของอนุภาคที่มีประจุเท่ากัน ดังนั้นจึงมีส่วนที่มีประจุบวกตรงกลางของอะตอม ซึ่งมีมวลสำคัญของอะตอมเข้มข้น จากการคำนวณพบว่าในการอธิบายการทดลองจำเป็นต้องใช้รัศมีของนิวเคลียสของอะตอมประมาณ 10 -15 เมตร
รัทเทอร์ฟอร์ดเสนอว่าอะตอมมีโครงสร้างเหมือนระบบดาวเคราะห์ สาระสำคัญของแบบจำลองโครงสร้างของอะตอมของรัทเทอร์ฟอร์ดมีดังนี้: ในใจกลางของอะตอมจะมีนิวเคลียสที่มีประจุบวกซึ่งมวลทั้งหมดมีความเข้มข้น อิเล็กตรอนหมุนรอบนิวเคลียสในวงโคจรเป็นวงกลมในระยะทางไกล (เช่นดาวเคราะห์ รอบดวงอาทิตย์) ประจุของนิวเคลียสเกิดขึ้นพร้อมกับจำนวนองค์ประกอบทางเคมีในตารางธาตุ
h คือค่าคงที่ของพลังค์
1. คำว่า “อะตอม” แปลจากภาษากรีกแปลว่า “แบ่งแยกไม่ได้” เป็นเวลานานจนถึงต้นศตวรรษที่ 20 อะตอมหมายถึงอนุภาคที่เล็กที่สุดของสสารซึ่งแบ่งแยกไม่ได้ เมื่อต้นศตวรรษที่ 20 วิทยาศาสตร์ได้สะสมข้อเท็จจริงมากมายที่บ่งบอกถึงโครงสร้างที่ซับซ้อนของอะตอม
ความก้าวหน้าอย่างมากในการศึกษาโครงสร้างของอะตอมเกิดขึ้นได้ในการทดลองของนักวิทยาศาสตร์ชาวอังกฤษ Ernest Rutherford เกี่ยวกับการกระเจิงของอนุภาคอัลฟ่าเมื่อผ่านชั้นบาง ๆ ของสสาร ในการทดลองเหล่านี้ ลำแสงอัลฟาแคบๆ ที่ปล่อยออกมาจากสารกัมมันตภาพรังสีมุ่งเป้าไปที่ฟอยล์สีทองบางๆ ตะแกรงถูกวางไว้ด้านหลังฟอยล์ ซึ่งสามารถเรืองแสงได้ภายใต้การกระแทกของอนุภาคเร็ว พบว่าอนุภาค α ส่วนใหญ่เบี่ยงเบนไปจากการแพร่กระจายเป็นเส้นตรงหลังจากผ่านฟอยล์ กล่าวคือ อนุภาคกระจัดกระจาย และโดยทั่วไปอนุภาค α บางส่วนจะถูกส่งกลับ รัทเทอร์ฟอร์ดอธิบายการกระเจิงของอนุภาคแอลฟาโดยข้อเท็จจริงที่ว่าประจุบวกไม่กระจายสม่ำเสมอในลูกบอลที่มีรัศมี 10^~10 เมตร ดังที่คิดไว้ก่อนหน้านี้ แต่มีความเข้มข้นในส่วนกลางของอะตอม - นิวเคลียสของอะตอม เมื่อเคลื่อนผ่านใกล้นิวเคลียส อนุภาคที่มีประจุบวกจะถูกผลักไส และเมื่อมันกระทบนิวเคลียส ก็จะถูกเหวี่ยงกลับไปในทิศทางตรงกันข้าม นี่คือลักษณะการทำงานของอนุภาคที่มีประจุเท่ากัน ดังนั้นจึงมีส่วนที่มีประจุบวกตรงกลางของอะตอม ซึ่งมีมวลสำคัญของอะตอมเข้มข้น จากการคำนวณพบว่า ในการอธิบายการทดลอง จำเป็นต้องใช้รัศมีของนิวเคลียสของอะตอมให้อยู่ที่ประมาณ 10^~15 เมตร
รัทเทอร์ฟอร์ดเสนอว่าอะตอมมีโครงสร้างเหมือนระบบดาวเคราะห์ สาระสำคัญของแบบจำลองโครงสร้างของอะตอมของรัทเทอร์ฟอร์ดมีดังนี้: ในใจกลางของอะตอมจะมีนิวเคลียสที่มีประจุบวกซึ่งมวลทั้งหมดมีความเข้มข้น อิเล็กตรอนหมุนรอบนิวเคลียสในวงโคจรเป็นวงกลมในระยะทางไกล (เช่นดาวเคราะห์ รอบดวงอาทิตย์) ประจุของนิวเคลียสเกิดขึ้นพร้อมกับจำนวนองค์ประกอบทางเคมีในตารางธาตุ
แบบจำลองดาวเคราะห์ของโครงสร้างของอะตอมของรัทเธอร์ฟอร์ดไม่สามารถอธิบายข้อเท็จจริงที่รู้จักกันดีหลายประการ: อิเล็กตรอนที่มีประจุจะต้องตกลงบนนิวเคลียสเนื่องจากแรงดึงดูดของคูลอมบ์ และอะตอมเป็นระบบที่เสถียร เมื่อเคลื่อนที่ในวงโคจรเป็นวงกลมเข้าใกล้นิวเคลียส อิเล็กตรอนในอะตอมจะต้องปล่อยคลื่นแม่เหล็กไฟฟ้าออกมาทุกความถี่ที่เป็นไปได้ กล่าวคือ แสงที่ปล่อยออกมาจะต้องมีสเปกตรัมต่อเนื่อง แต่ในทางปฏิบัติผลลัพธ์จะแตกต่างออกไป คือ อิเล็กตรอนของอะตอมจะปล่อยแสง ที่มีสเปกตรัมของเส้น นักฟิสิกส์ชาวเดนมาร์ก Nielier Bohr เป็นคนแรกที่พยายามแก้ไขข้อขัดแย้งในแบบจำลองนิวเคลียร์ของดาวเคราะห์ในโครงสร้างอะตอม
Bohr ใช้ทฤษฎีของเขาอยู่บนพื้นฐานสองข้อ สมมุติฐานแรก: ระบบอะตอมสามารถอยู่ในสถานะคงที่หรือสถานะควอนตัมพิเศษเท่านั้น ซึ่งแต่ละสถานะมีพลังงานในตัวเอง ในสถานะคงที่ อะตอมจะไม่ปล่อยออกมา ซึ่งหมายความว่า อิเล็กตรอน (เช่น ในอะตอมไฮโดรเจน) สามารถอยู่ในวงโคจรที่กำหนดไว้อย่างดีหลายวงได้ วงโคจรของอิเล็กตรอนแต่ละวงสอดคล้องกับพลังงานจำเพาะมาก
สมมุติฐานที่สอง: ในระหว่างการเปลี่ยนจากสถานะนิ่งหนึ่งไปอีกสถานะหนึ่ง ควอนตัมของรังสีแม่เหล็กไฟฟ้าจะถูกปล่อยออกมาหรือดูดซับ พลังงานของโฟตอนเท่ากับความแตกต่างระหว่างพลังงานของอะตอมในสองสถานะ: , โดยที่
h คือค่าคงที่ของพลังค์
เมื่ออิเล็กตรอนเคลื่อนที่จากวงโคจรใกล้เคียงไปยังวงโคจรที่ไกลกว่า ระบบอะตอมจะดูดซับพลังงานควอนตัม เมื่ออิเล็กตรอนเคลื่อนที่จากวงโคจรระยะไกลไปยังวงโคจรที่ใกล้กว่าเมื่อเทียบกับนิวเคลียส ระบบอะตอมจะปล่อยพลังงานควอนตัมออกมา
ในทางวิทยาศาสตร์เชื่อกันมานานแล้วว่าอะตอมเป็นอนุภาคที่เล็กที่สุดและแยกออกจากกันไม่ได้
| 1. คนแรกที่ละเมิดแนวคิดเหล่านี้คือทอมสัน: เขาเชื่อว่าอะตอมเป็นสสารเชิงบวกชนิดหนึ่งซึ่งมีอิเล็กตรอนกระจายอยู่ “เหมือนลูกเกดในคัพเค้ก” ความสำคัญของทฤษฎีนี้คืออะตอมไม่ได้รับการยอมรับว่าแบ่งแยกไม่ได้อีกต่อไป |  |
| 2. รัทเทอร์ฟอร์ดทำการทดลองเรื่องการกระเจิงของอนุภาคแอลฟา ธาตุหนัก (ฟอยล์สีทอง) ถูกถล่มด้วยสารกัมมันตภาพรังสี รัทเทอร์ฟอร์ดคาดว่าจะเห็นวงกลมเรืองแสง แต่เขาเห็นวงแหวนเรืองแสง | |
| คำอธิบายของรัทเทอร์ฟอร์ด: ศูนย์กลางของอะตอมมีประจุบวกทั้งหมด และอิเล็กตรอนไม่มีผลต่อการไหลของอนุภาคแอลฟา | |
| 3. แบบจำลองดาวเคราะห์ของอะตอมไฮโดรเจนตาม BORU | ด้วยการเปล่งพลังงานส่วนหนึ่ง (มองเห็นได้) อะตอมจะให้ชุดความยาวคลื่นของมันเองเท่านั้น นั่นก็คือสเปกตรัม ประเภทของสเปกตรัม: 1. สเปกตรัมการแผ่รังสี (การปล่อยก๊าซเรือนกระจก): (ได้มาจากวัตถุที่อยู่ในสถานะร้อน) ก) ของแข็ง - ให้อะตอมทั้งหมดในก๊าซที่เป็นของแข็ง ของเหลว หรือหนาแน่น b) มีเส้น - ให้อะตอมอยู่ในสถานะก๊าซ 1. สเปกตรัมการดูดกลืนแสง: หากแสงผ่านสสาร สารนี้จะดูดซับคลื่นที่ปล่อยออกมาในสภาวะร้อนอย่างแน่นอน (แถบสีเข้มปรากฏบนสเปกตรัมต่อเนื่อง) การวิเคราะห์สเปกตรัมเป็นวิธีการกำหนดองค์ประกอบทางเคมีของสารจากสเปกตรัมการปล่อยหรือการดูดซึมของสาร วิธีการนี้ขึ้นอยู่กับข้อเท็จจริงที่ว่าองค์ประกอบทางเคมีแต่ละชนิดมีความยาวคลื่นของตัวเอง การประยุกต์ใช้การวิเคราะห์สเปกตรัม:ในอาชญวิทยา การแพทย์ ฟิสิกส์ดาราศาสตร์ สเปกโตรกราฟเป็นอุปกรณ์สำหรับทำการวิเคราะห์สเปกตรัม สเปกโตรสโคปแตกต่างจากสเปกโตรกราฟตรงที่ไม่เพียงแต่ใช้ในการสังเกตสเปกตรัมเท่านั้น แต่ยังใช้ในการถ่ายภาพสเปกตรัมด้วย ตั๋วหมายเลข 21 1. วิธีทางอุณหพลศาสตร์เพื่อศึกษาปรากฏการณ์ทางกายภาพ พลังงานภายในและวิธีการเปลี่ยนแปลง กฎข้อที่หนึ่งของอุณหพลศาสตร์ การประยุกต์กฎข้อที่หนึ่งของอุณหพลศาสตร์กับกระบวนการไอโซเทอร์มอล ไอโซโคริก และอะเดียแบติก 2. แบบจำลองโครงสร้างของนิวเคลียสของอะตอม กองกำลังนิวเคลียร์ แบบจำลองนิวเคลียสของนิวเคลียส พลังงานยึดเหนี่ยวนิวเคลียร์ ปฏิกิริยานิวเคลียร์ 1. แต่ละร่างมีโครงสร้างเฉพาะเจาะจงมากประกอบด้วยอนุภาคที่เคลื่อนที่อย่างวุ่นวายและมีปฏิสัมพันธ์ซึ่งกันและกัน ดังนั้นร่างกายใด ๆ จึงมีพลังงานภายใน พลังงานภายในเป็นปริมาณที่แสดงลักษณะของร่างกายเอง เช่น พลังงานของการเคลื่อนที่ที่วุ่นวาย (ความร้อน) ของอนุภาคขนาดเล็กของระบบ (โมเลกุล อะตอม อิเล็กตรอน นิวเคลียส ฯลฯ) และพลังงานจากอันตรกิริยาของอนุภาคเหล่านี้ พลังงานภายในของก๊าซในอุดมคติที่มีอะตอมเดี่ยวถูกกำหนดโดยสูตร U = 3/2 t/M RT พลังงานภายในของร่างกายสามารถเปลี่ยนแปลงได้ก็ต่อเมื่อมีปฏิสัมพันธ์กับร่างกายอื่นเท่านั้น มีสองวิธีในการเปลี่ยนพลังงานภายใน: การถ่ายเทความร้อนและงานเชิงกล (เช่น การทำความร้อนระหว่างการเสียดสีหรือการบีบอัด การระบายความร้อนระหว่างการขยายตัว) การถ่ายเทความร้อนคือการเปลี่ยนแปลงของพลังงานภายในโดยไม่ต้องทำงาน: พลังงานถูกถ่ายโอนจากวัตถุที่มีความร้อนมากกว่าไปยังวัตถุที่มีความร้อนน้อยกว่า การถ่ายเทความร้อนมีสามประเภท: การนำความร้อน (การแลกเปลี่ยนพลังงานโดยตรงระหว่างอนุภาคที่เคลื่อนที่อย่างวุ่นวายของวัตถุที่มีปฏิสัมพันธ์หรือส่วนต่าง ๆ ของร่างกายเดียวกัน); การพาความร้อน (การถ่ายโอนพลังงานโดยการไหลของของเหลวหรือก๊าซ) และการแผ่รังสี (การถ่ายโอนพลังงานด้วยคลื่นแม่เหล็กไฟฟ้า) การวัดพลังงานที่ถ่ายโอนระหว่างการถ่ายเทความร้อนคือปริมาณความร้อน (Q) วิธีการเหล่านี้จะรวมกันในเชิงปริมาณในกฎการอนุรักษ์พลังงานซึ่งสำหรับกระบวนการทางความร้อนอ่านดังนี้: การเปลี่ยนแปลงพลังงานภายในของระบบปิดเท่ากับผลรวมของปริมาณความร้อนที่ถ่ายโอนไปยังระบบและการทำงานของภายนอก แรงที่กระทำต่อระบบ โดยที่การเปลี่ยนแปลงพลังงานภายในคือ Q คือปริมาณความร้อนที่ถ่ายโอนไปยังระบบ A คืองานของแรงภายนอก หากระบบทำงานได้ ระบบจะกำหนดให้ A* ตามอัตภาพ จากนั้นกฎการอนุรักษ์พลังงานสำหรับกระบวนการทางความร้อนซึ่งเรียกว่ากฎข้อที่หนึ่งของอุณหพลศาสตร์สามารถเขียนได้ดังนี้: เช่น ปริมาณความร้อนที่ถ่ายโอนไปยังระบบจะไปสู่การทำงานของระบบและการเปลี่ยนแปลงพลังงานภายใน ในระหว่างการทำความร้อนแบบไอโซบาริก ก๊าซจะทำงานบนแรงภายนอก โดยที่ V1 และ V2 เป็นปริมาตรเริ่มต้นและสุดท้ายของก๊าซ หากกระบวนการไม่ใช่ไอโซบาริก ปริมาณงานสามารถกำหนดได้จากพื้นที่ของรูป ABCD ที่อยู่ระหว่างเส้นที่แสดงการพึ่งพา p(V) และปริมาตรเริ่มต้นและสุดท้ายของก๊าซ V
ขอให้เราพิจารณาการประยุกต์ใช้กฎข้อที่หนึ่งของอุณหพลศาสตร์กับกระบวนการไอโซโพรเซสที่เกิดขึ้นกับก๊าซในอุดมคติ ในกระบวนการไอโซเทอร์มอล อุณหภูมิจะคงที่ ดังนั้นพลังงานภายในจึงไม่เปลี่ยนแปลง จากนั้นสมการของกฎข้อแรกของอุณหพลศาสตร์จะอยู่ในรูปแบบ: กล่าวคือ ปริมาณความร้อนที่ถ่ายโอนไปยังระบบจะไปทำงานระหว่างการขยายตัวของอุณหภูมิคงที่ ซึ่งเป็นสาเหตุที่อุณหภูมิไม่เปลี่ยนแปลง ในกระบวนการไอโซบาริก ก๊าซจะขยายตัวและปริมาณความร้อนที่ถ่ายเทไปยังก๊าซจะไปเพิ่มพลังงานภายในและทำงาน: ในระหว่างกระบวนการไอโซคอริก ก๊าซจะไม่เปลี่ยนปริมาตร ดังนั้นจึงไม่มีงานใดเกิดขึ้น เช่น A = 0 และสมการของกฎข้อที่หนึ่งมีรูปแบบ กล่าวคือ ปริมาณความร้อนที่ถ่ายโอนไปเพื่อเพิ่มปริมาณภายใน พลังงานของก๊าซ อะเดียแบติกเป็นกระบวนการที่เกิดขึ้นโดยไม่มีการแลกเปลี่ยนความร้อนกับสิ่งแวดล้อม Q = 0 ดังนั้น เมื่อก๊าซขยายตัว มันทำงานโดยการลดพลังงานภายใน ดังนั้น ก๊าซจึงเย็นลง เส้นโค้งที่แสดงกระบวนการอะเดียแบติกเรียกว่าอะเดียแบติก นิวเคลียสของอะตอมของสารใดๆ ประกอบด้วยโปรตอนและนิวตรอน (ชื่อสามัญของโปรตอนและนิวตรอนคือนิวคลีออน) จำนวนโปรตอนเท่ากับประจุของนิวเคลียสและตรงกับหมายเลของค์ประกอบในตารางธาตุ ผลรวมของจำนวนโปรตอนและนิวตรอนเท่ากับเลขมวล ตัวอย่างเช่น นิวเคลียสของอะตอมออกซิเจนประกอบด้วยโปรตอน 8 ตัว และนิวตรอน 16 - 8 = 8 ตัว นิวเคลียสของอะตอมประกอบด้วยโปรตอน 92 ตัว และ 235 - 92 = 143 นิวตรอน เรียกว่าแรงที่ยึดโปรตอนและนิวตรอนในนิวเคลียส กองกำลังนิวเคลียร์. นี่คือการโต้ตอบประเภทที่ทรงพลังที่สุด ในปี 1932 นักฟิสิกส์ชาวอังกฤษ James Chadwick ค้นพบอนุภาคที่มีประจุไฟฟ้าและมวลต่อหน่วยเป็นศูนย์ อนุภาคเหล่านี้เรียกว่านิวตรอน นิวตรอนถูกกำหนดให้เป็น n หลังจากการค้นพบนิวตรอน นักฟิสิกส์ D. D. Ivanenko และ W. Heisenberg ในปี 1932 ได้หยิบยกแบบจำลองโปรตอน-นิวตรอนของนิวเคลียสของอะตอม ตามแบบจำลองนี้ นิวเคลียสของอะตอมของสารใดๆ ประกอบด้วยโปรตอนและนิวตรอน (ชื่อสามัญของโปรตอนและนิวตรอนคือนิวคลีออน) จำนวนโปรตอนเท่ากับประจุของนิวเคลียสและตรงกับหมายเลของค์ประกอบในตารางธาตุ ผลรวมของจำนวนโปรตอนและนิวตรอนเท่ากับเลขมวล ตัวอย่างเช่น นิวเคลียสของอะตอมออกซิเจนประกอบด้วยโปรตอน 8 ตัว และนิวตรอน 16 - 8 = 8 ตัว นิวเคลียสของอะตอมประกอบด้วยโปรตอน 92 ตัว และ 235 - 92 = 143 นิวตรอน สารเคมีที่อยู่ในตำแหน่งเดียวกันในตารางธาตุ แต่มีมวลอะตอมต่างกัน เรียกว่า ไอโซโทป นิวเคลียสของไอโซโทปมีจำนวนนิวตรอนต่างกัน ตัวอย่างเช่น ไฮโดรเจนมีไอโซโทป 3 ไอโซโทป ได้แก่ โปรเทียม - นิวเคลียสประกอบด้วยโปรตอน 1 ตัว ดิวทีเรียม - นิวเคลียสประกอบด้วยโปรตอน 1 ตัวและนิวตรอน 1 ตัว ทริเทียม - นิวเคลียสประกอบด้วยโปรตอน 1 ตัวและนิวตรอน 2 ตัว ถ้าเราเปรียบเทียบมวลของนิวเคลียสกับมวลของนิวคลีออนปรากฎว่ามวลของนิวเคลียสของธาตุหนักมากกว่าผลรวมของมวลของโปรตอนและนิวตรอนในนิวเคลียสและสำหรับธาตุเบามวลของนิวเคลียส น้อยกว่าผลรวมของมวลโปรตอนและนิวตรอนในนิวเคลียส ดังนั้นจึงมีความแตกต่างของมวลระหว่างมวลของนิวเคลียสกับผลรวมของมวลของโปรตอนและนิวตรอนที่เรียกว่าข้อบกพร่องของมวล M = Mn - (Mp + Mn) เนื่องจากมีการเชื่อมต่อกันระหว่างมวลและพลังงาน ดังนั้นในระหว่างการฟิชชันของนิวเคลียสหนักและในระหว่างการสังเคราะห์นิวเคลียสของแสง พลังงานจึงต้องถูกปล่อยออกมาที่มีอยู่เนื่องจากข้อบกพร่องของมวล และพลังงานนี้เรียกว่าพลังงานยึดเหนี่ยวของนิวเคลียสของอะตอม การปล่อยพลังงานนี้สามารถเกิดขึ้นได้ในระหว่างปฏิกิริยานิวเคลียร์ ปฏิกิริยานิวเคลียร์เป็นกระบวนการของการเปลี่ยนแปลงประจุของนิวเคลียสและมวลของมัน ซึ่งเกิดขึ้นระหว่างอันตรกิริยาของนิวเคลียสกับนิวเคลียสอื่นหรืออนุภาคมูลฐาน เมื่อปฏิกิริยานิวเคลียร์เกิดขึ้น จะต้องเป็นไปตามกฎการอนุรักษ์ประจุไฟฟ้าและเลขมวล: ผลรวมของประจุ (เลขมวล) ของนิวเคลียสและอนุภาคที่เข้าสู่ปฏิกิริยานิวเคลียร์จะเท่ากับผลรวมของประจุ (เลขมวล) ของ ผลิตภัณฑ์ขั้นสุดท้าย (นิวเคลียสและอนุภาค) ของปฏิกิริยา ปฏิกิริยาลูกโซ่ฟิชชันเป็นปฏิกิริยานิวเคลียร์ซึ่งอนุภาคที่ก่อให้เกิดปฏิกิริยาจะเกิดขึ้นเป็นผลคูณของปฏิกิริยา เงื่อนไขที่จำเป็นสำหรับการพัฒนาโซ่ |
พ.ศ. 2449 (ค.ศ. 1906) - อี. รัทเทอร์ฟอร์ดทำการทดลองเพื่อทดสอบความสอดคล้องของแบบจำลองอะตอมของทอมสัน: ในสุญญากาศ ในแก้วตะกั่ว มีแหล่งกำเนิดรังสีกัมมันตภาพรังสี (อนุภาคอัลฟา) - พอโลเนียม (Po)
แผ่นทองคำบางๆ ถูกถล่มด้วยอนุภาคแอลฟาที่มีประจุบวก ซึ่งมีความเร็วประมาณ 20,000 กิโลเมตรต่อวินาที
แสงวาบจากอนุภาคอัลฟ่าที่กระทบถูกบันทึกไว้บนหน้าจอ
นอกจากหน้าจอหลักแล้ว ยังมีการบันทึกร่องรอยของอนุภาคอัลฟ่าบนหน้าจอด้านข้างอีกด้วย เมื่อรู้ว่าอนุภาคที่มีประจุเหมือนกันมีปฏิกิริยาอย่างไร และพวกมันผลักกัน เราสามารถอธิบายผลลัพธ์ของการทดลองของรัทเทอร์ฟอร์ดได้:
อนุภาคที่เบี่ยงเบนไปจะบินเข้ามาใกล้นิวเคลียส
อนุภาคที่สะท้อนกระทบนิวเคลียสพอดี
อนุภาคที่ไม่มีการโก่งตัวจะบินไปไกลจากนิวเคลียส
คำถามที่ 83. ทฤษฎีควอนตัม (แม็กซ์พลังค์)
พลังค์ตั้งสมมติฐานพิเศษว่า การแผ่รังสีของวัตถุสีดำถูกส่งไปยังพื้นที่โดยรอบไม่ต่อเนื่องกัน แต่อยู่ในรูปของส่วนเล็กๆ ที่แยกจากกัน ซึ่งเขาเรียกว่าแอคชันควอนตัม
ในความพยายามที่จะเอาชนะความยากลำบากของทฤษฎีคลาสสิกในการอธิบายรังสีวัตถุดำ เอ็ม. พลังค์ในปี 1900 ได้เสนอสมมติฐาน: อะตอมปล่อยพลังงานแม่เหล็กไฟฟ้าออกมาในส่วนที่แยกจากกัน - ควอนตัมพลังงาน อี
ที่ไหน h=6.63.10-34 ค่าคงที่ของ J.s-Planck
บางครั้งก็สะดวกในการวัดพลังงานและค่าคงที่ของพลังค์ในหน่วยโวลต์อิเล็กตรอน
แล้ว h=4.136.10-15 eV.s. ในฟิสิกส์อะตอมก็ใช้ปริมาณเช่นกัน
(1 eV คือพลังงานที่ประจุเบื้องต้นได้มาเมื่อผ่านความต่างศักย์เร่งที่ 1 V โดย 1 eV = 1.6.10-19 J)
ดังนั้น M. Planck จึงชี้ให้เห็นทางออกจากความยากลำบากที่พบในทฤษฎีการแผ่รังสีความร้อนหลังจากนั้นทฤษฎีทางกายภาพสมัยใหม่ก็เริ่มพัฒนาขึ้นเรียกว่า ฟิสิกส์ควอนตัม
คำถามที่ 84. การเลือกการเคลื่อนที่ของสารหล่อเย็นร่วมกัน
การเคลื่อนที่สัมพัทธ์ของสารหล่อเย็นมีอิทธิพลอย่างมากต่อกระบวนการถ่ายเทความร้อน มีตัวเลือกต่อไปนี้สำหรับทิศทางการเคลื่อนที่ของสารหล่อเย็นร่วมกัน: A) กระแสไปข้างหน้าB) ทวนโฟลว์ B) ข้ามกระแส D) กระแสผสม
การเลือกทิศทางการเคลื่อนที่ร่วมกันของสารหล่อเย็น สำหรับกรณีการไหลโดยตรง อุณหภูมิสุดท้ายของสารหล่อเย็นที่ให้ความร้อนน้อย (สารทำความเย็น) t2K จะต้องไม่เกินอุณหภูมิสุดท้ายของสารหล่อเย็นที่ให้ความร้อนมากกว่า t1K ด้วยการไหลทวนสิ่งนี้จึงเป็นไปได้ กระบวนการที่จะเกิดขึ้นจะต้องมีอุณหภูมิที่แตกต่างกันบ้าง เมื่อ t2K เพิ่มขึ้น ปริมาณการใช้น้ำหล่อเย็นจะลดลง เช่น ควรใช้การไหลทวนจากมุมมองของการประหยัดน้ำหล่อเย็น
หากเราเปรียบเทียบการไหลทวนและการไหลไปข้างหน้าที่อุณหภูมิเริ่มต้นและสุดท้ายของสารหล่อเย็นที่เท่ากัน เมื่อไหลทวน แรงผลักดันโดยเฉลี่ยก็จะสูงขึ้น และการไหลของสารหล่อเย็นจะเท่ากัน อัตราการถ่ายเทความร้อนด้วยการไหลทวนจะสูงกว่า ดังนั้นการไหลทวนจึงมีประสิทธิภาพมากกว่า
ดังนั้นการไหลทวนจะดีกว่าเมื่อดำเนินกระบวนการถ่ายเทความร้อน การไหลตรงจะใช้เฉพาะในกรณีที่ให้ข้อได้เปรียบทางเทคโนโลยีเท่านั้น (เช่น การสร้างสภาวะความร้อนที่เบาลง)
หากสารหล่อเย็นตัวใดตัวหนึ่งเปลี่ยนสถานะการรวมตัว ทิศทางการเคลื่อนที่สัมพัทธ์ของสารหล่อเย็นก็ไม่สำคัญ
คำถามที่ 85. การกระจายตัวของแสง การกระจายตัวปกติและผิดปกติ ความเร็วเฟสและกลุ่มของแสง อุปกรณ์สเปกตรัม
การกระจายตัวของแสง (การสลายตัวของแสง) เป็นปรากฏการณ์ที่เกิดจากการพึ่งพาดัชนีการหักเหสัมบูรณ์ของสารกับความถี่ (หรือความยาวคลื่น) ของแสง (การกระจายความถี่) หรือในสิ่งเดียวกันคือการพึ่งพาความเร็วเฟสของ แสงในสสารที่มีความยาวคลื่น (หรือความถี่) นิวตันค้นพบโดยการทดลองประมาณปี ค.ศ. 1672 แม้ว่าในทางทฤษฎีจะอธิบายได้ค่อนข้างดีในภายหลังก็ตาม
การกระจายตัวเชิงพื้นที่คือการขึ้นอยู่กับเทนเซอร์ค่าคงตัวไดอิเล็กตริกของตัวกลางบนเวกเตอร์คลื่น การพึ่งพาอาศัยกันนี้ทำให้เกิดปรากฏการณ์หลายอย่างที่เรียกว่าเอฟเฟกต์โพลาไรเซชันเชิงพื้นที่
ตัวอย่างหนึ่งของการกระจายตัวที่ชัดเจนที่สุดคือการสลายตัวของแสงสีขาวเมื่อผ่านปริซึม (การทดลองของนิวตัน) สาระสำคัญของปรากฏการณ์การกระจายตัวคือความแตกต่างในความเร็วเฟสของการแพร่กระจายของรังสีแสงที่มีความยาวคลื่นต่างกันในสารโปร่งใส - สื่อแสง (ในขณะที่อยู่ในสุญญากาศความเร็วของแสงจะเท่ากันเสมอโดยไม่คำนึงถึงความยาวคลื่นและสีด้วยเหตุนี้ ). โดยทั่วไป ยิ่งความถี่ของคลื่นแสงสูง ดัชนีการหักเหของตัวกลางก็จะยิ่งสูงขึ้น และความเร็วเฟสของคลื่นในตัวกลางก็จะยิ่งต่ำลง:
สำหรับแสงสีแดง ความเร็วเฟสของการแพร่กระจายในตัวกลางคือสูงสุด และระดับการหักเหของแสงคือขั้นต่ำ
แสงสีม่วงมีความเร็วเฟสขั้นต่ำในการแพร่กระจายในตัวกลาง และมีระดับการหักเหสูงสุด
อย่างไรก็ตาม ในสารบางชนิด (เช่น ในไอโอดีน) พบว่ามีการกระจายตัวที่ผิดปกติ โดยที่รังสีสีฟ้าหักเหน้อยกว่าสีแดง ในขณะที่รังสีอื่นๆ จะถูกดูดซับโดยสารและหลบเลี่ยงการสังเกต พูดอย่างเคร่งครัดมากขึ้นการกระจายตัวที่ผิดปกตินั้นแพร่หลายเช่นพบได้ในก๊าซเกือบทั้งหมดที่ความถี่ใกล้กับเส้นดูดกลืน แต่ในไอโอดีนนั้นค่อนข้างสะดวกสำหรับการสังเกตในช่วงแสงซึ่งพวกมันดูดซับแสงได้แรงมาก
การกระจายตัวของแสงทำให้สามารถแสดงให้เห็นลักษณะการประกอบกันของแสงสีขาวได้อย่างน่าเชื่อเป็นครั้งแรก
แสงสีขาวถูกสลายตัวเป็นสเปกตรัมอันเป็นผลมาจากการผ่านตะแกรงการเลี้ยวเบนหรือการสะท้อนกลับจากมัน (ซึ่งไม่เกี่ยวข้องกับปรากฏการณ์การกระจายตัว แต่อธิบายได้โดยธรรมชาติของการเลี้ยวเบน) สเปกตรัมการเลี้ยวเบนและปริซึมมีความแตกต่างกันบ้าง: สเปกตรัมปริซึมถูกบีบอัดในส่วนสีแดงและยืดออกเป็นสีม่วง และจัดเรียงตามความยาวคลื่นจากมากไปน้อย: จากสีแดงเป็นสีม่วง สเปกตรัมปกติ (การเลี้ยวเบน) มีความสม่ำเสมอในทุกพื้นที่และจัดเรียงตามความยาวคลื่นที่เพิ่มขึ้น: จากสีม่วงไปจนถึงสีแดง
โดยการเปรียบเทียบกับการกระจายตัวของแสง ปรากฏการณ์ที่คล้ายกันของการพึ่งพาการแพร่กระจายของคลื่นที่มีลักษณะอื่นใดบนความยาวคลื่น (หรือความถี่) เรียกอีกอย่างว่าการกระจายตัว ด้วยเหตุนี้ คำว่า กฎการกระจาย ซึ่งใช้เป็นชื่อของความสัมพันธ์เชิงปริมาณที่เชื่อมต่อความถี่และหมายเลขคลื่น ไม่เพียงแต่ใช้กับคลื่นแม่เหล็กไฟฟ้าเท่านั้น แต่ยังใช้กับกระบวนการคลื่นใดๆ อีกด้วย
การกระจายตัวอธิบายถึงข้อเท็จจริงที่ว่ารุ้งกินน้ำปรากฏขึ้นหลังฝนตก (แม่นยำยิ่งขึ้นคือความจริงที่ว่ารุ้งนั้นมีหลายสีและไม่ใช่สีขาว)
การกระจายตัวเป็นสาเหตุของความคลาดเคลื่อนสี ซึ่งเป็นหนึ่งในความคลาดเคลื่อนของระบบออพติคอล รวมถึงเลนส์ถ่ายภาพและวิดีโอ
Augustin Cauchy เสนอสูตรเชิงประจักษ์สำหรับการประมาณค่าการพึ่งพาดัชนีการหักเหของตัวกลางต่อความยาวคลื่น:
ความยาวคลื่นในสุญญากาศอยู่ที่ไหน a, b, c เป็นค่าคงที่ซึ่งต้องกำหนดค่าสำหรับแต่ละวัสดุโดยการทดลอง ในกรณีส่วนใหญ่ คุณสามารถจำกัดตัวเองให้อยู่แค่สองเทอมแรกของสูตร Cauchy ได้ ต่อมามีการเสนอสูตรการประมาณที่แม่นยำยิ่งขึ้น แต่ในขณะเดียวกันก็ซับซ้อนมากขึ้น
ดังนั้นการกระจายตัวของแสงจึงขึ้นอยู่กับดัชนีการหักเหของแสงของสารกับความถี่ของคลื่นแสง ความสัมพันธ์นี้ไม่ใช่เชิงเส้นหรือซ้ำซาก ขอบเขตของค่า ν ซึ่ง
อะตอมประกอบด้วยนิวเคลียสที่มีประจุบวกที่มีขนาดกะทัดรัดและมีมวลมาก และมีอิเล็กตรอนแสงที่มีประจุลบอยู่รอบๆ
เออร์เนสต์ รัทเทอร์ฟอร์ดเป็นนักวิทยาศาสตร์ที่มีเอกลักษณ์เฉพาะตัวในแง่ที่ว่าเขาได้ค้นพบสิ่งใหม่ๆ ที่สำคัญแล้ว หลังจากได้รับรางวัลโนเบล ในปี 1911 เขาประสบความสำเร็จในการทดลองที่ไม่เพียงแต่ทำให้นักวิทยาศาสตร์สามารถมองลึกเข้าไปในอะตอมและรับข้อมูลเชิงลึกเกี่ยวกับโครงสร้างของมัน แต่ยังกลายเป็นแบบอย่างแห่งความสง่างามและความลึกของการออกแบบอีกด้วย
รัทเทอร์ฟอร์ดใช้แหล่งกำเนิดรังสีกัมมันตภาพรังสีตามธรรมชาติสร้างปืนใหญ่ที่ผลิตกระแสอนุภาคที่มีทิศทางและโฟกัส ปืนดังกล่าวเป็นกล่องตะกั่วที่มีช่องแคบ ภายในมีการวางสารกัมมันตภาพรังสีไว้ ด้วยเหตุนี้ อนุภาค (ในกรณีนี้คืออนุภาคอัลฟา ซึ่งประกอบด้วยโปรตอนสองตัวและนิวตรอนสองตัว) ที่ปล่อยออกมาจากสารกัมมันตภาพรังสีในทุกทิศทาง ยกเว้นอนุภาคหนึ่งถูกดูดซับโดยตะแกรงตะกั่ว และมีเพียงลำอนุภาคอัลฟาที่พุ่งตรงเท่านั้นที่ถูกปล่อยออกมาผ่านช่องนั้น . ไกลออกไปตามเส้นทางของลำแสงยังมีตะแกรงตะกั่วอีกหลายแห่งที่มีช่องแคบๆ ที่ตัดอนุภาคที่เบี่ยงเบนไปจากทิศทางที่กำหนดอย่างเคร่งครัด เป็นผลให้ลำแสงอนุภาคอัลฟ่าที่โฟกัสอย่างสมบูรณ์แบบบินไปยังเป้าหมาย และตัวเป้าหมายเองก็เป็นแผ่นฟอยล์สีทองบาง ๆ มันเป็นรังสีอัลฟ่าที่โจมตีเธอ หลังจากการชนกับอะตอมฟอยล์ อนุภาคอัลฟ่ายังคงเคลื่อนที่ต่อไปและชนแผ่นกรองเรืองแสงที่ติดตั้งอยู่ด้านหลังเป้าหมาย ซึ่งมีการบันทึกแสงวาบเมื่ออนุภาคอัลฟ่าชนเป้าหมาย จากนั้นผู้ทดลองสามารถตัดสินได้ว่าอนุภาคอัลฟ่าเบี่ยงเบนไปจากทิศทางการเคลื่อนที่เป็นเส้นตรงในปริมาณเท่าใดและเท่าใดซึ่งเป็นผลมาจากการชนกับอะตอมฟอยล์
การทดลองประเภทนี้เคยเกิดขึ้นมาก่อน แนวคิดหลักของพวกเขาคือการรวบรวมข้อมูลที่เพียงพอจากมุมโก่งตัวของอนุภาคเพื่อให้สามารถพูดบางสิ่งที่ชัดเจนเกี่ยวกับโครงสร้างของอะตอมได้ ในตอนต้นของศตวรรษที่ 20 นักวิทยาศาสตร์รู้อยู่แล้วว่าอะตอมประกอบด้วยอิเล็กตรอนที่มีประจุลบ อย่างไรก็ตาม แนวคิดที่มีอยู่ทั่วไปก็คืออะตอมนั้นมีลักษณะคล้ายกับกริดละเอียดที่มีประจุบวกซึ่งเต็มไปด้วยอิเล็กตรอนลูกเกดที่มีประจุลบ ซึ่งเป็นแบบจำลองที่เรียกว่า "แบบจำลองกริดลูกเกด" จากผลการทดลองดังกล่าว นักวิทยาศาสตร์สามารถเรียนรู้คุณสมบัติบางอย่างของอะตอม โดยเฉพาะอย่างยิ่ง การประมาณลำดับขนาดทางเรขาคณิตของพวกมัน
อย่างไรก็ตาม รัทเทอร์ฟอร์ดตั้งข้อสังเกตว่าไม่มีคนรุ่นก่อนๆ ของเขาคนใดที่พยายามทดสอบด้วยการทดลองว่าอนุภาคแอลฟาบางส่วนเบี่ยงเบนไปจากมุมที่กว้างมากหรือไม่ แบบจำลองตารางลูกเกดไม่อนุญาตให้มีองค์ประกอบโครงสร้างในอะตอมที่มีความหนาแน่นและหนักมากจนสามารถเบี่ยงเบนอนุภาคแอลฟาที่รวดเร็วในมุมที่มีนัยสำคัญ ดังนั้นจึงไม่มีใครสนใจที่จะทดสอบความเป็นไปได้นี้ รัทเทอร์ฟอร์ดขอให้นักเรียนคนหนึ่งของเขาติดตั้งอุปกรณ์ติดตั้งใหม่ในลักษณะที่สามารถสังเกตการกระเจิงของอนุภาคแอลฟาในมุมโก่งขนาดใหญ่ - เพียงเพื่อเคลียร์มโนธรรมของเขา และขจัดความเป็นไปได้นี้ออกไปโดยสิ้นเชิง เครื่องตรวจจับเป็นตะแกรงที่เคลือบด้วยโซเดียมซัลไฟด์ ซึ่งเป็นวัสดุที่ทำให้เกิดแสงวาบฟลูออเรสเซนต์เมื่ออนุภาคอัลฟากระทบกับมัน ลองนึกภาพความประหลาดใจที่ไม่เพียงแต่กับนักเรียนที่ทำการทดลองโดยตรงเท่านั้น แต่ยังรวมถึงตัว Rutherford เองด้วยเมื่อปรากฏว่าอนุภาคบางส่วนเบี่ยงเบนไปเป็นมุมสูงถึง 180°!
ภายในกรอบของแบบจำลองอะตอมที่สร้างขึ้น ไม่สามารถตีความผลลัพธ์ได้: ไม่มีอะไรในตารางลูกเกดที่สามารถสะท้อนอนุภาคอัลฟาที่ทรงพลัง เร็ว และหนักได้ รัทเทอร์ฟอร์ดถูกบังคับให้สรุปว่าในอะตอมมวลส่วนใหญ่มีความเข้มข้นในสสารที่มีความหนาแน่นอย่างไม่น่าเชื่อซึ่งอยู่ที่ใจกลางอะตอม และอะตอมที่เหลือกลับกลายเป็นว่ามีความหนาแน่นน้อยกว่าที่คิดไว้มาก นอกจากนี้ยังเป็นไปตามพฤติกรรมของอนุภาคแอลฟาที่กระจัดกระจายซึ่งอยู่ในศูนย์กลางความหนาแน่นยิ่งยวดของอะตอม ซึ่งรัทเทอร์ฟอร์ดเรียกว่า แกนประจุไฟฟ้าบวกทั้งหมดของอะตอมก็มีความเข้มข้นเช่นกัน เนื่องจากมีเพียงแรงผลักไฟฟ้าเท่านั้นที่สามารถทำให้เกิดการกระเจิงของอนุภาคในมุมที่มากกว่า 90°
หลายปีต่อมา รัทเทอร์ฟอร์ดชอบใช้การเปรียบเทียบนี้เกี่ยวกับการค้นพบของเขา ในประเทศหนึ่งทางตอนใต้ของทวีปแอฟริกา เจ้าหน้าที่ศุลกากรได้รับคำเตือนว่าอาวุธจำนวนมากกำลังจะถูกลักลอบเข้าประเทศเพื่อกลุ่มกบฏ และอาวุธเหล่านั้นจะถูกซ่อนอยู่ในกองฝ้าย และบัดนี้ หลังจากขนถ่ายลงแล้ว เจ้าหน้าที่ศุลกากรก็หันหน้าไปทางโกดังที่เต็มไปด้วยกองฝ้าย เขาจะทราบได้อย่างไรว่าก้อนใดมีปืนไรเฟิล เจ้าหน้าที่ศุลกากรแก้ไขปัญหาได้ง่ายๆ: เขาเริ่มยิงไปที่มัดฟาง และหากกระสุนแฉลบจากมัดใดๆ เขาก็ระบุได้ว่ามัดมัดนั้นเป็นอาวุธที่ลักลอบนำเข้าตามสัญลักษณ์นี้ ดังนั้น Rutherford เมื่อเห็นว่าอนุภาคอัลฟาสะท้อนกลับจากฟอยล์สีทองได้อย่างไร ก็พบว่ามีโครงสร้างที่หนาแน่นกว่ามากที่ซ่อนอยู่ภายในอะตอมมากกว่าที่คาดไว้
รูปภาพของอะตอมที่ Rutherford วาดโดยอิงจากผลการทดลองของเขาเป็นที่รู้จักกันดีสำหรับเราในปัจจุบัน อะตอมประกอบด้วยนิวเคลียสที่มีความหนาแน่นสูงมากซึ่งมีประจุบวกและมีอิเล็กตรอนแสงที่มีประจุลบอยู่รอบๆ ต่อมา นักวิทยาศาสตร์ได้ให้พื้นฐานทางทฤษฎีที่เชื่อถือได้สำหรับภาพนี้ ( ซม.บอร์ อะตอม) แต่ทั้งหมดเริ่มต้นด้วยการทดลองง่ายๆ กับตัวอย่างเล็กๆ ของวัสดุกัมมันตภาพรังสีและแผ่นฟอยล์สีทอง
ดูสิ่งนี้ด้วย:
เออร์เนสต์ รัทเทอร์ฟอร์ด บารอนรัทเทอร์ฟอร์ดแห่งเนลสันที่ 1 พ.ศ. 2414-2480
นักฟิสิกส์ชาวนิวซีแลนด์ เกิดในเนลสัน ลูกชายของชาวนาช่างฝีมือ ได้รับทุนไปศึกษาต่อที่มหาวิทยาลัยเคมบริดจ์ ประเทศอังกฤษ หลังจากสำเร็จการศึกษา เขาได้รับการแต่งตั้งให้เป็นมหาวิทยาลัย McGill ของแคนาดา ซึ่งเขาได้ก่อตั้งกฎพื้นฐานของปรากฏการณ์กัมมันตภาพรังสีร่วมกับ Frederick Soddy (พ.ศ. 2420-2509) ซึ่งเขาได้รับรางวัลโนเบลสาขาเคมีในปี พ.ศ. 2451 ในไม่ช้านักวิทยาศาสตร์ก็ย้ายไปที่มหาวิทยาลัยแมนเชสเตอร์ซึ่งภายใต้การนำของเขา Hans Geiger (พ.ศ. 2425-2488) ได้ประดิษฐ์เครื่องนับ Geiger อันโด่งดังของเขาเริ่มค้นคว้าโครงสร้างของอะตอมและในปี พ.ศ. 2454 ก็ได้ค้นพบการมีอยู่ของนิวเคลียสของอะตอม ในช่วงสงครามโลกครั้งที่หนึ่ง เขามีส่วนร่วมในการพัฒนาโซนาร์ (เรดาร์อะคูสติก) เพื่อตรวจจับเรือดำน้ำของศัตรู ในปีพ.ศ. 2462 เขาได้รับแต่งตั้งเป็นศาสตราจารย์ด้านฟิสิกส์และเป็นผู้อำนวยการห้องปฏิบัติการคาเวนดิชแห่งมหาวิทยาลัยเคมบริดจ์ และในปีเดียวกันนั้นก็ได้ค้นพบการสลายตัวของนิวเคลียร์อันเป็นผลมาจากการทิ้งระเบิดด้วยอนุภาคหนักพลังงานสูง รัทเทอร์ฟอร์ดยังคงอยู่ในตำแหน่งนี้ไปจนวาระสุดท้ายของชีวิต ขณะเดียวกันก็เป็นประธานของ Royal Scientific Society เป็นเวลาหลายปี เขาถูกฝังไว้ที่เวสต์มินสเตอร์แอบบีย์ ถัดจากนิวตัน ดาร์วิน และฟาราเดย์
แม้แต่ในสมัยโบราณก็มีความคิดที่ว่าจักรวาลประกอบด้วยอนุภาคขนาดเล็กที่แบ่งแยกไม่ได้ - อะตอม แนวคิดเกี่ยวกับโครงสร้างของสสารนี้ยังคงอยู่จนถึงปลายศตวรรษที่ 19 เมื่อต้นศตวรรษที่ 20 เป็นที่ยอมรับอย่างน่าเชื่อถือว่าแต่ละอะตอมมีอิเล็กตรอน ลำดับความสำคัญในการค้นพบอิเล็กตรอนเป็นของนักฟิสิกส์ชาวอังกฤษ J. Thomson ในเวลาเดียวกันเป็นที่ทราบกันดีอยู่แล้วว่าอะตอมมีความเป็นกลางทางไฟฟ้า ดังนั้นประจุลบของอิเล็กตรอนจะต้องได้รับการชดเชยด้วยประจุบวกของอนุภาคที่ไม่รู้จักซึ่งรวมอยู่ในประจุของอะตอม
ในช่วงทศวรรษที่ 90 ของศตวรรษที่ 19 แบบจำลองอะตอมของเจ. ทอมสันในรูปแบบของตัวกลางทรงกลมที่เป็นเนื้อเดียวกันและเป็นเชิงบวกซึ่งมีการกระจายอิเล็กตรอนที่มีประจุลบเหมือนลูกเกดในขนมปัง แบบจำลองอะตอมของเจ. ทอมสันก็เหมือนกับคัพเค้ก อย่างไรก็ตาม ในไม่ช้า ผู้เขียนแบบจำลอง "คัพเค้ก" ได้แนะนำตำแหน่งที่ไม่คงที่ของอิเล็กตรอนในอะตอม
แบบจำลองที่สมจริงที่สุดดูเหมือนจะเป็นแบบจำลองอะตอมของนิวเคลียร์หรือดาวเคราะห์โดย E. Rutherford ซึ่งเสนอโดยนักฟิสิกส์ชาวอังกฤษในปี 1911 แบบจำลองดาวเคราะห์เป็นผลจากการทดลองของอี. รัทเธอร์ฟอร์ดและเพื่อนร่วมงานเกี่ยวกับการกระเจิงของอนุภาคแอลฟา การทดลองประกอบด้วยสิ่งต่อไปนี้ ลำแสงอนุภาค α ที่มีประจุบวกพุ่งไปที่แผ่นทองคำรูปทรงฟอยล์บางๆ ด้านหลังฟอยล์มีตะแกรงที่ปกคลุมไปด้วยสารเรืองแสงวาบ ซึ่งเป็นสารที่ปล่อยแสง ณ จุดที่อนุภาคแอลฟากระทบ จากแบบจำลองของเจ. ทอมสัน คาดว่าอนุภาค α จะไม่ถูกเบี่ยงเบนผ่านมุมที่กว้าง เนื่องจากอิเล็กตรอนมีน้ำหนักเบากว่าอนุภาค α มาก และแท้จริงแล้ว การทดลองแสดงให้เห็นว่าอนุภาคอัลฟาส่วนใหญ่ผ่านไปอย่างอิสระผ่านแผ่นฟอยล์ ราวกับว่าโดยพื้นฐานแล้วมันเป็นพื้นที่ว่าง ถึงกระนั้น อนุภาค α บางตัวก็เบี่ยงเบนไปในมุมเล็กๆ ซึ่งเป็นไปตามที่ใครๆ คาดเดากันว่าเป็นผลมาจากอันตรกิริยากับประจุบวกของอะตอม แต่สิ่งที่ไม่คาดคิดและน่าทึ่งก็คืออนุภาค α จำนวนเล็กน้อยกระจัดกระจายในมุมกว้างถึง 180° สิ่งนี้จะเกิดขึ้นได้ก็ต่อเมื่ออนุภาค α ที่มีประจุบวกประสบกับแรงผลักจากประจุบวกขนาดใหญ่ที่กระจุกตัวอยู่ในพื้นที่เล็กๆ
ตามแบบจำลองของอี. รัทเทอร์ฟอร์ด อะตอมประกอบด้วยนิวเคลียสขนาดใหญ่ที่มีประจุบวก ซึ่ง 99.94% ของมวลอะตอมนั้นมีความเข้มข้น ขนาดของประจุบวกประมาณโดยผลิตภัณฑ์ ze โดยที่ z คือเลขอะตอมขององค์ประกอบทางเคมีในตารางของ D. Mendeleev e - ค่าใช้จ่ายเบื้องต้น รอบนิวเคลียสภายในทรงกลมที่มีเส้นผ่านศูนย์กลางภายนอกประมาณ 10 -10 ม. อิเล็กตรอน z จะหมุนในวงโคจรทรงรีปิด ทำให้เกิดเปลือกอิเล็กตรอนของอะตอม อิเล็กตรอนไม่สามารถอยู่นิ่งในอะตอมได้ เนื่องจากในกรณีนี้ พวกมันจะตกเข้าสู่นิวเคลียสภายใต้อิทธิพลของแรงดึงดูดคูลอมบ์ ตามการประมาณการของ E. Rutherford ขนาดของนิวเคลียสควรอยู่ในลำดับ 10 -15 -10 -14 เมตร เมื่อเปรียบเทียบขนาดของนิวเคลียสและอะตอม เราก็ได้ข้อสรุปว่าอิเล็กตรอนควรอยู่ห่างจาก นิวเคลียสที่ระยะ (10-100) 103 มากกว่าขนาดเคอร์เนล และด้วยเหตุนี้ข้อสรุปที่สอง: ส่วนใหญ่ของอะตอมคือพื้นที่ว่าง
ข้อเสียของแบบจำลองของอี. รัทเธอร์ฟอร์ดคือการไม่สามารถอธิบายข้อเท็จจริงเกี่ยวกับเสถียรภาพที่ยอดเยี่ยมของอะตอมได้ ประการแรก ในระหว่างการชนกับอะตอมอื่น ประการที่สองตามกฎของฟิสิกส์คลาสสิกการหมุนของอิเล็กตรอนรอบนิวเคลียสไม่สามารถเสถียรได้เนื่องจากจะต้องมาพร้อมกับรังสีแม่เหล็กไฟฟ้าเช่นเดียวกับการเคลื่อนที่ด้วยความเร่งของอนุภาคที่มีประจุ และตามกฎของฟิสิกส์คลาสสิก อิเล็กตรอนที่เคลื่อนที่เป็นวงกลมมีความเร่งสู่ศูนย์กลาง แรงสู่ศูนย์กลางที่ยึดอิเล็กตรอนไว้ในวงโคจรรัศมี r คือแรงคูลอมบ์ของแรงดึงดูดของอิเล็กตรอนไปยังนิวเคลียส:
โดยที่ ε o = 8.85 10 -12 F/m - ค่าคงที่ทางไฟฟ้า ม. อี - มวลอิเล็กตรอน, กก.; v คือความเร็วของอิเล็กตรอนในวงโคจร m/s การสร้างสนามแม่เหล็กไฟฟ้าต้องใช้พลังงาน พลังงานของอิเล็กตรอนควรค่อยๆ ลดลง และด้วยความเร็วของการหมุนของอิเล็กตรอนรอบนิวเคลียส อิเล็กตรอนจะต้องตกลงไปในนิวเคลียสในที่สุด อย่างไรก็ตาม อะตอมเป็นรูปแบบที่ค่อนข้างเสถียรและสามารถดำรงอยู่ได้นานหลายพันล้านปี ประการที่สาม ตามแบบจำลองของอี. รัทเธอร์ฟอร์ด สเปกตรัมการแผ่รังสีของอะตอมควรมีความต่อเนื่อง การทดลองแสดงให้เห็นว่าสเปกตรัมการปล่อยก๊าซของอะตอมเฉพาะนั้นไม่ต่อเนื่องกัน
ประสบการณ์ของรัทเทอร์ฟอร์ด
Ernst RUTHERFORD (1871-1937) นักฟิสิกส์ชาวอังกฤษ หนึ่งในผู้ก่อตั้งหลักคำสอนเรื่องกัมมันตภาพรังสีและโครงสร้างของอะตอม ผู้ก่อตั้งโรงเรียนวิทยาศาสตร์ สมาชิกต่างประเทศของ Russian Academy of Sciences (1922) และสมาชิกกิตติมศักดิ์ของ สถาบันวิทยาศาสตร์แห่งสหภาพโซเวียต (2468) ผู้อำนวยการห้องปฏิบัติการคาเวนดิช (ตั้งแต่ปี 1919) ค้นพบรังสีอัลฟ่าและเบต้า (พ.ศ. 2442) และกำหนดธรรมชาติของพวกมัน สร้าง (1903 ร่วมกับ F. Soddy) ทฤษฎีกัมมันตภาพรังสี เสนอ (1911) แบบจำลองดาวเคราะห์ของอะตอม ดำเนินการ (พ.ศ. 2462) ปฏิกิริยานิวเคลียร์ประดิษฐ์ครั้งแรก ทำนาย (พ.ศ. 2464) การมีอยู่ของนิวตรอน รางวัลโนเบล (1908)การทดลองของรัทเทอร์ฟอร์ด (1906) เกี่ยวกับการกระเจิงของอนุภาคที่มีประจุเร็วผ่านชั้นบางๆ ของสสาร ทำให้สามารถศึกษาโครงสร้างภายในของอะตอมได้ ในการทดลองเหล่านี้ อนุภาคอัลฟาถูกนำมาใช้ในการตรวจสอบอะตอม ซึ่งเป็นอะตอมฮีเลียมที่แตกตัวเป็นไอออนเต็มที่ ซึ่งเป็นผลมาจากการสลายตัวของกัมมันตภาพรังสีของเรเดียมและองค์ประกอบอื่นๆ รัทเทอร์ฟอร์ดระดมยิงอะตอมของโลหะหนักด้วยอนุภาคเหล่านี้
รัทเทอร์ฟอร์ดรู้ว่าอะตอมประกอบด้วยอนุภาคที่มีประจุลบแบบเบา ได้แก่ อิเล็กตรอนและอนุภาคที่มีประจุบวกหนัก เป้าหมายหลักของการทดลองคือค้นหาว่าประจุบวกมีการกระจายภายในอะตอมอย่างไร การกระเจิงของอนุภาคα - (นั่นคือการเปลี่ยนแปลงทิศทางการเคลื่อนที่) อาจเกิดจากส่วนที่มีประจุบวกของอะตอมเท่านั้น
การทดลองแสดงให้เห็นว่าอนุภาค α บางส่วนกระจัดกระจายในมุมขนาดใหญ่ใกล้กับ 180 องศา กล่าวคือ พวกมันถูกโยนกลับไป สิ่งนี้จะเกิดขึ้นได้ก็ต่อเมื่อประจุบวกของอะตอมกระจุกตัวอยู่ในส่วนกลางที่เล็กมากของอะตอม - นิวเคลียสของอะตอม มวลเกือบทั้งหมดของอะตอมก็กระจุกตัวอยู่ในนิวเคลียสเช่นกัน
ปรากฎว่านิวเคลียสของอะตอมต่างๆ มีเส้นผ่านศูนย์กลางประมาณ 10 -14 – 10 -15 ซม. ในขณะที่ขนาดของอะตอมนั้นอยู่ที่ data10 -8 ซม. นั่นคือ 10 4 – 10 5 เท่าของขนาด นิวเคลียส
ดังนั้นอะตอมจึงกลายเป็น "ว่างเปล่า"
จากการทดลองเกี่ยวกับการกระเจิงของอนุภาค α บนนิวเคลียสของอะตอม รัทเธอร์ฟอร์ดได้มาถึง ไปจนถึงแบบจำลองดาวเคราะห์ของอะตอม. ตามแบบจำลองนี้ อะตอมประกอบด้วยนิวเคลียสที่มีประจุบวกขนาดเล็กและอิเล็กตรอนที่โคจรรอบอะตอม
จากมุมมองของฟิสิกส์คลาสสิก อะตอมดังกล่าวจะต้องไม่เสถียร เนื่องจากอิเล็กตรอนที่เคลื่อนที่ในวงโคจรด้วยความเร่งจะต้องปล่อยพลังงานแม่เหล็กไฟฟ้าออกมาอย่างต่อเนื่อง
การพัฒนาแนวคิดเพิ่มเติมเกี่ยวกับโครงสร้างของอะตอมจัดทำโดย N. Bohr (1913) บนพื้นฐานของแนวคิดควอนตัม
งานห้องปฏิบัติการ
การทดลองนี้สามารถทำได้โดยใช้อุปกรณ์พิเศษซึ่งมีภาพวาดแสดงในรูปที่ 1 อุปกรณ์นี้เป็นกล่องตะกั่วที่มีสุญญากาศอยู่ภายในและกล้องจุลทรรศน์

การกระเจิง (เปลี่ยนทิศทางการเคลื่อนที่) ของอนุภาค α อาจเกิดจากส่วนที่มีประจุบวกของอะตอมเท่านั้น ดังนั้น จากการกระเจิงของอนุภาค α จึงเป็นไปได้ที่จะกำหนดลักษณะของการกระจายตัวของประจุบวกและมวลภายในอะตอมได้ แผนภาพการทดลองของรัทเทอร์ฟอร์ดแสดงในรูปที่ 1 ลำแสงของอนุภาค α ที่ปล่อยออกมาจากยากัมมันตภาพรังสีถูกปล่อยออกมาโดยไดอะแฟรม จากนั้นตกลงบนแผ่นฟอยล์บางๆ ของวัสดุที่กำลังศึกษา (ในกรณีนี้คือทองคำ) หลังจากการกระเจิง อนุภาค α จะตกลงบนตะแกรงที่เคลือบด้วยซิงค์ซัลไฟด์ การชนกันของอนุภาคแต่ละชนิดกับตะแกรงนั้นมาพร้อมกับแสงวาบ (แวววาว) ซึ่งสามารถสังเกตได้ผ่านกล้องจุลทรรศน์
ด้วยสุญญากาศที่ดีภายในอุปกรณ์และในกรณีที่ไม่มีฟอยล์ แถบแสงก็ปรากฏขึ้นบนหน้าจอ ซึ่งประกอบด้วยแสงแวววาวที่เกิดจากลำแสงบาง ๆ ของอนุภาค α แต่เมื่อวางฟอยล์บนเส้นทางของลำแสง อนุภาค α เนื่องจากการกระเจิงจึงถูกกระจายไปทั่วพื้นที่ขนาดใหญ่ของหน้าจอ
ในการทดลองของเรา เราจำเป็นต้องตรวจสอบอนุภาค α ซึ่งพุ่งตรงไปที่แกนทองคำเมื่อทำมุม 180° (รูปที่ 2) และติดตามปฏิกิริยาของอนุภาค α เช่น อนุภาคαจะเข้าใกล้แกนทองคำในระยะทางขั้นต่ำเท่าใด (รูปที่ 3)
 ข้าว. 2
ข้าว. 2
 รูปที่ 3
รูปที่ 3
ที่ให้ไว้:
V 0 =1.6*10 7 เมตร/วินาที – ความเร็วเริ่มต้น
ง = 10 -13
อาร์ นาที =?
คำถาม:
ระยะทางต่ำสุด r นาที ระหว่างอนุภาค α และนิวเคลียสที่สามารถทำได้ในการทดลองนี้คือเท่าใด (รูปที่ 4)
 รูปที่ 4
รูปที่ 4
สารละลาย:
ในการทดลองของเรา อนุภาค α ถูกแสดงเป็นอะตอม
Z=2 – โปรตอน
น= อู๋ – Z = 4 – 2 = 2 นิวตรอน
ม.พี = กิโลกรัม
Z=79 – จำนวนโปรตอน
น= อู๋ – Z = 196 – 79 = 117 (นิวตรอน)

![]()
![]() คลาส 2 /
H ∙m 2 – ค่าคงที่ทางไฟฟ้า
คลาส 2 /
H ∙m 2 – ค่าคงที่ทางไฟฟ้า