ในปี 1906 รัทเทอร์ฟอร์ดค้นพบการกระเจิงของอนุภาค α วิธีการของรัทเทอร์ฟอร์ดมีดังนี้ ลวดที่เคลือบด้วยเรเดียม C ถูกวางไว้ในช่องในแผ่นตะกั่ว มีการวางช่องแคบไว้เหนือเส้นลวด อนุภาค α ที่ผ่านช่องนี้ตกลงบนจานถ่ายภาพ ทั้งหมดนี้ถูกใส่ไว้ในกระบอกทองเหลืองซึ่งมีการสูบลมออกมา ทรงกระบอกถูกวางไว้ระหว่างขั้วของแม่เหล็กไฟฟ้า ซึ่งเป็นเส้นแรงที่วิ่งขนานกับเส้นลวด ลายเส้นที่เกิดขึ้นบนแผ่นถ่ายภาพถูกจำกัดไว้อย่างชัดเจนในความว่างเปล่า หากกระบอกสูบเต็มไปด้วยอากาศ แถบก็จะกว้างขึ้นและขอบก็จะเบลอ หากช่องว่างถูกปกคลุมด้วยชั้นบางๆ ของสารบางชนิด แถบจะกว้างขึ้นและความเข้มจะค่อยๆ ลดลงจากกึ่งกลางไปจนถึงขอบ
ในปี พ.ศ. 2452-2453 G. Geiger ศึกษาการกระเจิงของอนุภาค α อย่างระมัดระวังโดยใช้วิธีการเรืองแสงวาบ อุปกรณ์ไกเกอร์แสดงไว้ในรูปที่นำมาจากบทความของไกเกอร์เมื่อปี 1910 โดยนำเรดอนเข้าไปในท่อรูปกรวย L โดยมีไมกาบางๆ ปิดอยู่ และยังคงอยู่ในนั้นเป็นเวลาหลายชั่วโมง จากนั้นเรดอนจะถูกดูดเข้าไปในภาชนะ B และไม่นานหลังจากที่อนุภาค a ทั้งหมดถูกเรเดียม: C ออกมาก็สะสมอยู่บนผนังของท่อ Slit D เลือกลำแสงแคบจากกระแสของอนุภาค α ที่ปล่อยออกมาจากเรเดียม C ซึ่งให้ภาพความสว่างที่สดใสบนหน้าจอซิงค์ซัลไฟด์ S ถ้าแผ่นบางๆ ของสารที่อยู่ระหว่างการศึกษาถูกวางไว้ใน E ความแวววาวบนแผ่นกรองซิงค์ซัลไฟด์ หน้าจอจะลดลงเนื่องจากการกระเจิงของอนุภาค α ผลลัพธ์ของการทดลองจะแสดงเป็นเส้นโค้ง โดยจะพล็อตมุมการกระเจิงตามแกนแอบซิสซา และจำนวนอนุภาคที่กระจัดกระจายในมุมที่กำหนดจะถูกพล็อตไปตามแกนพิกัด จากการทดลองของไกเกอร์สรุปได้ว่า:
- มุมการกระเจิงที่เป็นไปได้มากที่สุด (นั่นคือ มุมซึ่งจำนวนอนุภาคที่กระจัดกระจายมากที่สุด) จะเพิ่มขึ้นสำหรับความหนาเล็กน้อยโดยประมาณตามสัดส่วนของรากที่สองของความหนาของสารที่อนุภาค α ทะลุผ่าน สำหรับความหนาที่มากขึ้น การกระเจิงจะเพิ่มขึ้นเร็วขึ้นมาก
- มุมที่เป็นไปได้มากที่สุดที่อนุภาคจะเบี่ยงเบนไปเมื่อผ่านอะตอมจะเป็นสัดส่วนกับน้ำหนักอะตอม ค่าที่แท้จริงของมุมนี้ในกรณีของอะตอมทองคำคือประมาณ 1/200 ขององศา
- มุมการกระเจิงที่เป็นไปได้มากที่สุดจะเพิ่มขึ้นอย่างรวดเร็วเมื่อความเร็วของอนุภาค α ลดลง โดยเป็นการประมาณครั้งแรก ซึ่งจะแปรผกผันกับกำลังสามของความเร็ว
ปรากฏการณ์ที่น่าทึ่งที่สุดที่สังเกตได้ระหว่างการกระเจิงของอนุภาค α คือข้อเท็จจริงที่ค้นพบในปี 1909 ไกเกอร์และ มาร์สเดนโดยที่อนุภาคเล็กๆ บางส่วนกระจัดกระจายในมุมที่กว้างมาก จนอนุภาคลอยกลับไปยังแหล่งกำเนิด สำหรับอนุภาคอัลฟาที่ปล่อยออกมาจากเรเดียม C ประมาณหนึ่งใน 8,000 อนุภาคจะกระจัดกระจายในมุมที่มากกว่ามุมขวา

จะอธิบายข้อเท็จจริงนี้ได้อย่างไร? สมมติว่าอะตอมมีโครงสร้างตามที่เสนอ ดี.ดี. ทอมสันดังนั้นการโก่งตัวครั้งเดียวของอนุภาค α เมื่อชนกับอะตอมดังกล่าวจะมีขนาดเล็กมาก และมุมกระเจิงขนาดใหญ่สามารถตีความได้ว่าเป็นผลสะสมที่เกิดจากการโก่งตัวหลายครั้ง การคำนวณโดย Thomson และ Rutherford เองแสดงให้เห็นว่าแม้จะมีการชนกันเป็นจำนวนมาก แต่ผลการโก่งตัวของอนุภาค α ก็ควรจะมีขนาดเล็กมาก “ฉันได้แสดงให้เห็นแล้ว” รัทเทอร์ฟอร์ดเขียนในปี 1914 “ว่าแบบจำลองของอะตอมที่ลอร์ดเคลวินเสนอและออกแบบอย่างละเอียดโดยเซอร์ ดี. ดี. ทอมสัน ไม่สามารถให้ค่าเบี่ยงเบนขนาดใหญ่เช่นนั้นได้ เว้นแต่จะถือว่าเส้นผ่านศูนย์กลางของทรงกลมเชิงบวกนั้นเล็กมาก ” .
ความจำเป็นในการตีความผลการทดลองของไกเกอร์และมาร์สเดนทำให้รัทเทอร์ฟอร์ดไปสู่แบบจำลองนิวเคลียร์ของอะตอม เขาได้รายงานการค้นพบของเขาเป็นครั้งแรกในบทความเรื่อง "การกระเจิงของ α- และ β-Rays และโครงสร้างของอะตอม" อ่านที่สมาคมปรัชญาแมนเชสเตอร์เมื่อวันที่ 7 มีนาคม พ.ศ. 2454 เรานำเสนอข้อความนี้โดยคำนึงถึงประวัติศาสตร์อันยิ่งใหญ่ของอะตอม ความสำคัญ
“ เป็นที่ทราบกันดีว่าอนุภาค α- และ β จะเบี่ยงเบนไปจากเส้นทางตรงของมันในระหว่างการชนกับอะตอมของสสาร การกระเจิงของอนุภาค β เนื่องจากช่วงเวลาเล็ก ๆ ของพวกมัน (เช่น โมเมนตัม - P.K. ) และพลังงานโดยทั่วไปนั้นยิ่งใหญ่กว่ามาก มากกว่าการโก่งตัวของอนุภาค α ดูเหมือนว่าแน่นอนว่าอนุภาคที่เคลื่อนที่เร็วเหล่านี้ผ่านระบบอะตอมและการศึกษาโดยละเอียดเกี่ยวกับการโก่งตัวที่เกิดขึ้นน่าจะทำให้เกิดแสงบนโครงสร้างทางไฟฟ้าของอะตอม โดยทั่วไปสันนิษฐานว่าการกระเจิงที่สังเกตได้คือ เป็นผลจากการกระจัดกระจายเล็กๆ น้อยๆ มากมายครับท่าน D.D. Thomson (Proc. Camb. Phil. Soc. 15, p. 5, 1910)เมื่อเร็ว ๆ นี้ทฤษฎีของการกระเจิงขนาดเล็กได้ก้าวหน้าไป และข้อสรุปหลักของทฤษฎีได้รับการตรวจสอบเชิงทดลองแล้ว Grouter (Proc. Roy. Soc. 84, p. 226, 1910). ตามทฤษฎีนี้ สันนิษฐานว่าอะตอมประกอบด้วยทรงกลมที่เกิดไฟฟ้าบวกซึ่งมีประจุไฟฟ้าลบอยู่ในรูปของคลังข้อมูลในปริมาณเท่ากัน เมื่อเปรียบเทียบทฤษฎีกับการทดลอง Grouter สรุปว่าจำนวนคอร์พัสเคิลในอะตอมมีค่ามากกว่าน้ำหนักอะตอมประมาณสามเท่า โดยแสดงเป็นน้ำหนักของไฮโดรเจน อย่างไรก็ตาม มีการทดลองกระเจิงหลายครั้งที่แสดงให้เห็นว่าบางครั้งอนุภาค α และ β มีการโก่งตัวมากกว่า 90° ในการชนครั้งเดียว ตัวอย่างเช่น, Geiger และ Marsden (Proc. Roy. Soc. 82, p. 493, 1909)พบว่าส่วนเล็กๆ ของอนุภาค α ที่ตกลงบนแผ่นทองบางๆ มีการโก่งตัวมากกว่ามุมฉาก ความเบี่ยงเบนขนาดใหญ่ดังกล่าวไม่สามารถอธิบายได้ด้วยทฤษฎีความน่าจะเป็น โดยคำนึงถึงการกระเจิงเล็กน้อยที่สังเกตได้จากการทดลอง ดูเหมือนว่าการโก่งตัวขนาดใหญ่เหล่านี้จะเกิดขึ้นในการชนกันของอะตอมเพียงครั้งเดียว
เพื่ออธิบายผลลัพธ์เหล่านี้และผลลัพธ์อื่นๆ จำเป็นต้องถือว่าอนุภาคที่เกิดไฟฟ้าผ่านสนามไฟฟ้าที่รุนแรงในอะตอม การกระเจิงของอนุภาคมีประจุสามารถอธิบายได้โดยสมมติว่าอะตอมซึ่งประกอบด้วยประจุไฟฟ้าส่วนกลางที่มีความเข้มข้นที่จุดหนึ่งและล้อมรอบด้วยการกระจายทรงกลมสม่ำเสมอของกระแสไฟฟ้าตรงข้ามที่มีขนาดเท่ากัน ด้วยการจัดเรียงอะตอม อนุภาค α- และ β นี้ เมื่อพวกมันเคลื่อนผ่านจากศูนย์กลางของอะตอมในระยะใกล้ จะเกิดการโก่งตัวมาก แม้ว่าความน่าจะเป็นของการโก่งตัวมากจะมีน้อยก็ตาม ตามทฤษฎีนี้ เศษส่วนของจำนวนอนุภาคที่มีประจุทั้งหมดที่มีการเบี่ยงเบนระหว่างมุม Ф และ Ф+dФ จะได้รับจากการแสดงออก

โดยที่ n คือจำนวนอะตอมต่อหน่วยปริมาตรของวัสดุที่กระเจิง t คือความหนาเล็กน้อยของวัสดุและ ![]() โดยที่ Ne คือประจุที่ศูนย์กลางของอะตอม E คือประจุของอนุภาคที่ถูกไฟฟ้า m คือมวลของมัน และ u คือความเร็วของมัน
โดยที่ Ne คือประจุที่ศูนย์กลางของอะตอม E คือประจุของอนุภาคที่ถูกไฟฟ้า m คือมวลของมัน และ u คือความเร็วของมัน
ตามมาว่าจำนวนอนุภาคที่กระจัดกระจายต่อหน่วยพื้นที่สำหรับระยะทางคงที่จากจุดที่เกิดลำแสงจะแตกต่างกันไปตาม cosec 4 Ф / 2 กฎการกระจายนี้ได้รับการทดสอบทดลองโดย Geiger สำหรับอนุภาคαและพบว่าเป็น ใช้ได้ภายในขีดจำกัดของข้อผิดพลาดในการทดลอง
จากการอภิปรายผลทั่วไปของการกระเจิงโดยวัสดุต่างๆ พบว่าประจุกลางของอะตอมมีสัดส่วนใกล้เคียงกันมากกับน้ำหนักอะตอมของมัน ประจุที่แน่นอนบนนิวเคลียสส่วนกลางยังไม่ได้รับการพิจารณา แต่สำหรับอะตอมทองคำจะมีประจุประมาณ 100 หน่วย"
ในรูปแบบคลาสสิกที่ชัดเจนและรัดกุม โลกได้เรียนรู้เกี่ยวกับการค้นพบที่ยิ่งใหญ่ที่สุดครั้งหนึ่งในประวัติศาสตร์วิทยาศาสตร์
สองปีต่อมา รัทเทอร์ฟอร์ดบรรยายรายละเอียดงานของเขาและผลงานของผู้ร่วมงานซึ่งนำไปสู่การค้นพบแบบจำลองนิวเคลียร์ของอะตอมในหนังสือ "สารกัมมันตภาพรังสีและการแผ่รังสีของพวกเขา"
ต่อไปนี้เป็นการคำนวณที่ทำให้สามารถระบุจำนวนอนุภาคαที่กระจัดกระจายที่มุม φ ไปยังทิศทางเริ่มต้นของลำแสง:

โดยที่ n คือจำนวนอะตอมต่อหน่วยปริมาตรของสารกระเจิง, t คือความหนาของแผ่นกระเจิง, Q คือจำนวนอนุภาคα ที่ตกกระทบต่อหน่วยพื้นที่ของแผ่นกระเจิง, r คือระยะห่างจากแหล่งกำเนิด ไปที่หน้าจอ b คือค่าที่กำหนดโดยความเท่าเทียมกัน

โดยที่ Ne คือประจุของนิวเคลียสที่กระเจิง, E คือประจุของอนุภาค α, m คือมวลของมัน, V คือความเร็ว
กฎของรัทเธอร์ฟอร์ดช่วยให้เราไม่เพียงตรวจสอบความถูกต้องของสมมติฐานของโครงสร้างนิวเคลียร์ของอะตอมเท่านั้น แต่ยังตรวจสอบประจุของนิวเคลียส (Ne) อีกด้วย ไกเกอร์เริ่มทำการทดสอบทันทีในปีเดียวกันนั้นคือ พ.ศ. 2454 การทดลองยืนยันความถูกต้องของกฎโคเซค 4 φ / 2 และระบุว่าขนาดของประจุนั้นแปรผันตามน้ำหนักอะตอมโดยประมาณ ในปีพ.ศ. 2456 ไกเกอร์และมาร์สเดนได้ทำการทดสอบทดลองใหม่เกี่ยวกับสูตรของรัทเทอร์ฟอร์ดโดยใช้วิธีประกายแวววาว “มันเป็นงานที่ยากและอุตสาหะมาก” รัทเทอร์ฟอร์ดเขียน “เนื่องจากต้องนับอนุภาคหลายพันอนุภาค ผลลัพธ์ของ Geiger และ Marsden เห็นด้วยอย่างใกล้ชิดกับทฤษฎีนี้”
นี่คือข้อมูลบางส่วนจาก Geiger และ Marsden
เมื่อความเร็ว V เปลี่ยนแปลงและค่าคงที่อื่นๆ สูตรของรัทเทอร์ฟอร์ดจะให้ yV 4 = const ข้อมูลไกเกอร์-มาร์สเดน:
>
1 / V 4 (ค่าสัมพัทธ์) 1.0 1.21 1.50 1.91 2.84 4.32 9.22
สำหรับการพึ่งพามุม สูตรของรัทเทอร์ฟอร์ดให้ไว้

ตามคำกล่าวของไกเกอร์และมาร์สเดน

และสุดท้าย สำหรับการขึ้นอยู่กับประจุ (Ne) สูตรของรัทเธอร์ฟอร์ดให้ความคงตัวของอัตราส่วน v" / A 2 โดยที่ A คือน้ำหนักอะตอม, v" = v / nt - "จำนวนแสงแวววาวที่ลดลง" ตามคำกล่าวของไกเกอร์และมาร์สเดน

“ไกเกอร์และมาร์สเดนค้นพบ” รัทเทอร์ฟอร์ดชี้ให้เห็นว่า “การกระเจิงโดยอะตอมต่างๆ ของสสารนั้นจะมีสัดส่วนโดยประมาณกับกำลังสองของน้ำหนักอะตอม ซึ่งตามมาว่าประจุของอะตอมนั้นแปรผันโดยประมาณกับน้ำหนักอะตอม เมื่อพิจารณาจำนวนอนุภาค α ที่กระจัดกระจายด้วยแผ่นฟิล์มบางๆ ของทองคำ พวกเขาสรุปว่าประจุนิวเคลียร์ประมาณเท่ากับครึ่งหนึ่งของน้ำหนักอะตอมคูณด้วยประจุของอิเล็กตรอน เนื่องจากความยากลำบากในการทดลอง จึงหาจำนวนจริงได้โดยใช้เพียง มีความแม่นยำไม่เกิน 20%
“ ดังนั้น” รัทเธอร์ฟอร์ดสรุปการนำเสนอผลการทดลองของไกเกอร์และมาร์สเดน“ ผลการทดลองของไกเกอร์และมาร์สเดนกลายเป็นข้อตกลงที่สมบูรณ์กับการทำนายของทฤษฎีและระบุว่าสมมติฐานที่ฉันทำเกี่ยวกับโครงสร้าง ของอะตอมนั้นถูกต้องด้วยคุณสมบัติที่เรียบง่ายที่สุด” เป็นที่น่าสนใจที่จะสังเกตว่าย้อนกลับไปในปี 1913 รัทเทอร์ฟอร์ดยอมรับประจุของนิวเคลียสเท่ากับ +Ne กล่าวคือ เขาอนุญาตให้มีประจุทั้งบวกและลบของนิวเคลียสได้ แท้จริงแล้วกลศาสตร์การโก่งตัวช่วยให้อะตอมมีประจุทั้งบวกและลบ แต่ข้อเท็จจริงจำนวนหนึ่งและโดยเฉพาะอย่างยิ่งการศึกษาของ D. D. Thomson เกี่ยวกับรังสีบวกซึ่งเราจะหารือกันในไม่ช้า ได้แสดงให้เห็นว่าพาหะของกระแสไฟฟ้าบวกนั้นสัมพันธ์กับมวลที่มากกว่าหรือเท่ากับมวลของอะตอมไฮโดรเจนเสมอ นิวเคลียสขนาดใหญ่สามารถบรรทุกประจุบวกได้เท่านั้น จริงอยู่ที่ในปี 1913 บอร์ได้ข้อสรุปว่านิวเคลียสจะต้องมีอิเล็กตรอนอยู่ด้วย สมมติฐานนี้แสดงขึ้นครั้งแรกโดย Marie Skłodowska-Curie ไม่ว่าในกรณีใด ภายในปี 1913 ความสัมพันธ์ระหว่างประจุของนิวเคลียสกับเลขลำดับของธาตุในตารางธาตุก็ได้รับการชี้แจงในที่สุด (van den Broek, Moseley)
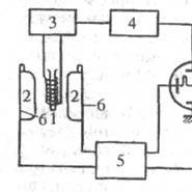
การทดลองคลาสสิกเกี่ยวกับการศึกษาโครงสร้างของอะตอมดำเนินการโดยเซอร์เออร์เนสต์ รัทเทอร์ฟอร์ดในปี พ.ศ. 2454 รัทเทอร์ฟอร์ดได้ทำการทดลองเพื่อศึกษาการกระเจิงของอนุภาคอัลฟาด้วยแผ่นฟอยล์โลหะบาง ๆ ผลกระทบต่ออะตอมเกิดจากการทิ้งระเบิดด้วยลำแสงอนุภาคขนาดใหญ่ แผนภาพการทดลองแสดงไว้ในรูปที่. 1.
ฟอยล์สีทองบาง F (ความหนาของฟอยล์ประมาณ 10 -7 ม. มีอะตอมประมาณ 400 อะตอมวางอยู่) ถูกวางไว้ภายในตะแกรงทรงกลม E ลำแสงอนุภาคอัลฟาเร็วที่ปล่อยออกมาจากกัมมันตภาพรังสีผ่านรูในตะแกรง ยาที่อยู่ในภาชนะตะกั่วตกลงไปในแนวตั้งฉากบนจานอาร์ อนุภาคอัลฟ่าเป็นอะตอมฮีเลียมที่แตกตัวเป็นไอออนอย่างสมบูรณ์ซึ่งมีมวลเท่ากับ 4.0015 อามู และประจุเท่ากับ + 2e
 (e คือค่าของประจุไฟฟ้าเบื้องต้น) ความเร็วของอนุภาคแอลฟามีค่าประมาณ 10 7 m/s พลังงานคือ 4.05 MeV เมื่อฟอยล์มีความหนาน้อย การชนกันของอนุภาคอัลฟ่าแทบจะเป็นชั้นเดียว กล่าวคือ แต่ละอนุภาคชนกับอะตอมเพียงอะตอมเดียว ทำให้ทิศทางการบินของมันเปลี่ยนไป
(e คือค่าของประจุไฟฟ้าเบื้องต้น) ความเร็วของอนุภาคแอลฟามีค่าประมาณ 10 7 m/s พลังงานคือ 4.05 MeV เมื่อฟอยล์มีความหนาน้อย การชนกันของอนุภาคอัลฟ่าแทบจะเป็นชั้นเดียว กล่าวคือ แต่ละอนุภาคชนกับอะตอมเพียงอะตอมเดียว ทำให้ทิศทางการบินของมันเปลี่ยนไป
ผนังด้านในของฉากถูกเคลือบด้วยสารเรืองแสง ซึ่งเป็นสารที่ทำให้เกิดแสงวาบเมื่ออนุภาคอัลฟ่ากระทบ ซึ่งทำให้สามารถลงทะเบียนอนุภาคอัลฟ่ากับอุปกรณ์ M ซึ่งกระจัดกระจายตามอะตอมในมุมต่างๆ θ จากทิศทางเดิม การทดลองเกี่ยวกับการกระเจิงของอนุภาคแอลฟาทำให้สามารถสร้างรูปแบบดังต่อไปนี้ได้
1. อนุภาคอัลฟ่าส่วนใหญ่จะผ่านฟอยล์อย่างอิสระเกือบจะไม่ถูกเบี่ยงเบนและไม่สูญเสียพลังงาน
2. อนุภาคเพียงเล็กน้อยเท่านั้น (0.01% นั่นคือหนึ่งหมื่น) ที่หันกลับมานั่นคือเปลี่ยนทิศทางการเคลื่อนที่ด้วยมุมที่มากกว่า 90 องศา
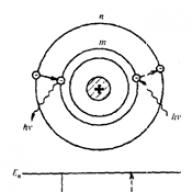
ผลลัพธ์ของการทดลองของรัทเทอร์ฟอร์ดสามารถอธิบายได้บนสมมติฐานที่ว่าประจุบวกทั้งหมดและมวลเกือบทั้งหมดของอะตอมนั้นมีความเข้มข้นในพื้นที่เล็ก ๆ ของอะตอม - นิวเคลียสซึ่งมีขนาดประมาณ 10 -14 ม. ในเชิงลบ อิเล็กตรอนที่มีประจุเคลื่อนที่รอบนิวเคลียสในพื้นที่ขนาดใหญ่ (เมื่อเทียบกับนิวเคลียส ) ซึ่งมีขนาดประมาณ 10 -10 เมตร
สมมติฐานนี้รองรับ แบบจำลองนิวเคลียร์ของอะตอมซึ่งเรียกอีกอย่างว่าดาวเคราะห์ จำนวนอิเล็กตรอนในอะตอมเท่ากับเลขอะตอมขององค์ประกอบในตารางธาตุเมนเดเลเยฟ นอกจากนี้ยังแสดงให้เห็นว่าแรงที่เชื่อมต่ออิเล็กตรอนกับนิวเคลียสนั้นอยู่ภายใต้กฎของคูลอมบ์
อย่างไรก็ตาม แบบจำลองนิวเคลียร์ขัดแย้งกับกฎของพลศาสตร์ไฟฟ้าแบบคลาสสิก ในความเป็นจริง หากอิเล็กตรอนอยู่นิ่งในอะตอม จะต้องตกลงสู่นิวเคลียสภายใต้อิทธิพลของแรงดึงดูดคูลอมบ์ หากอิเล็กตรอนโคจรรอบนิวเคลียส ก็ควรจะปล่อยสนามแม่เหล็กไฟฟ้าออกมา ในเวลาเดียวกัน มันสูญเสียพลังงานผ่านการแผ่รังสี ความเร็วของการเคลื่อนที่ลดลง และในที่สุดอิเล็กตรอนจะต้องตกลงสู่นิวเคลียส สเปกตรัมการปล่อยก๊าซของอะตอมในกรณีนี้ควรมีความต่อเนื่อง และอายุการใช้งานของอะตอมไม่ควรเกิน 10 -7 วินาที ในความเป็นจริง อะตอมมีความเสถียร และสเปกตรัมการปล่อยก๊าซของอะตอมไม่ต่อเนื่องกัน
บทเรียนฟิสิกส์ในเกรด 11
เรื่อง:
"การทดลองการกระเจิงของอนุภาคแอลฟาของรัทเทอร์ฟอร์ด"
เป้าหมายและวัตถุประสงค์ของบทเรียน:
เกี่ยวกับการศึกษา:
อธิบายกลไกการทดลองของรัทเทอร์ฟอร์ด
เกี่ยวกับการศึกษา:
พัฒนาความเป็นอิสระทางปัญญาของนักเรียน
มีส่วนสนับสนุนการศึกษาคุณธรรมและสุนทรียศาสตร์
เกี่ยวกับการศึกษา:
พัฒนาความสามารถในการเน้นหลักสำคัญเปรียบเทียบข้อเท็จจริงที่กำลังศึกษาและแสดงความคิดอย่างมีเหตุผล
ระหว่างเรียน:
ฉัน.องค์กร ช่วงเวลา.
ยืนตรงข้างโต๊ะและทำความสะอาดตัวเอง กล่าวสวัสดีกับอาจารย์ จากนั้นนั่งเงียบ ๆ บนที่นั่งของคุณและรักษาความสงบเรียบร้อยในห้องเรียน
การกำหนดหัวข้อและวัตถุประสงค์ของบทเรียน
ครั้งที่สอง การทำซ้ำ
สเปกตรัมเส้น
1.คำว่าอะตอมหมายถึงอะไร2.นักวิทยาศาสตร์คนใดค้นพบกฎของการทำซ้ำคุณสมบัติขององค์ประกอบทางเคมีเป็นระยะ?
3.อะตอมแบ่งแยกไม่ได้หรือไม่?
4.จะเกิดอะไรขึ้นกับก๊าซทำให้บริสุทธิ์เมื่อถูกความร้อนที่อุณหภูมิสูง?
5. เส้นหลากสีที่คั่นด้วยช่องว่างมืดชื่ออะไร
6.ก๊าซแต่ละชนิดมีอะไรบ้าง?
7.ก๊าซชนิดใดมีสเปกตรัมที่ง่ายที่สุด?
8.สเปกตรัมของก๊าซข้อใดประกอบด้วย 4 เส้น
9. นักวิทยาศาสตร์คนใดเลือกสูตรเส้นสเปกตรัมสำหรับบริเวณที่มองเห็นได้
10. ทฤษฎีของใครที่ทำให้สามารถรวมสูตรของบริเวณที่มองเห็น, อัลตราไวโอเลต และอินฟราเรด ให้เป็นสูตรทั่วไปสูตรเดียวได้
ฟิสมินุตกาตามวิดีโอ
สาม. วัสดุใหม่
§ 7.2 การทดลองของรัทเทอร์ฟอร์ด เรื่อง การกระเจิงของอนุภาคแอลฟา
โดยการศึกษาการกระเจิงของอนุภาคแอลฟาขณะผ่านแผ่นทองคำเออร์เนสต์รัทเทอร์ฟอร์ดได้ข้อสรุปว่าประจุบวกของอะตอมทั้งหมดกระจุกตัวอยู่ที่ศูนย์กลางในนิวเคลียสที่มีมวลมากและกะทัดรัด และอนุภาคที่มีประจุลบ (อิเล็กตรอน) จะหมุนรอบนิวเคลียสนี้

แบบจำลองนี้มีความแตกต่างโดยพื้นฐานจากแบบจำลองอะตอมของทอมสันซึ่งแพร่หลายในขณะนั้น

โจเซฟ จอห์นทอมสันเสนอแบบจำลองของอะตอมในรูปของพุดดิ้ง (พาย) ซึ่งมีประจุบวกเติมเต็มปริมาตรอะตอมทั้งหมดอย่างสม่ำเสมอ และอิเล็กตรอนก็กระจายไปด้วย

ต่อมาแบบจำลองของรัทเทอร์ฟอร์ดถูกเรียกว่าแบบจำลองดาวเคราะห์ของอะตอม (มันคล้ายกับระบบสุริยะมาก แกนกลางหนักคือดวงอาทิตย์ และอิเล็กตรอนที่หมุนรอบมันเป็นดาวเคราะห์)
ในปี 1912 อี. รัทเทอร์ฟอร์ดและผู้ร่วมงานของเขาได้ทำการทดลองเรื่องการกระเจิงของอนุภาคแอลฟาในสสาร

แผนการทดลองของรัทเธอร์ฟอร์ด
เมื่อไม่มีฟอยล์ วงกลมสว่างก็ปรากฏขึ้นบนหน้าจอ ซึ่งประกอบด้วยแสงแวววาวที่เกิดจากลำแสงอนุภาคอัลฟ่าบางๆ แต่เมื่อวางแผ่นฟอยล์สีทองบาง ๆ ที่มีความหนาประมาณ 0.1 μm (ไมครอน) ในเส้นทางของอนุภาคอัลฟ่า ภาพที่สังเกตได้บนหน้าจอก็เปลี่ยนไปอย่างมาก กล่าวคือ แสงวาบแต่ละครั้งไม่เพียงปรากฏอยู่นอกวงกลมก่อนหน้าเท่านั้น แต่ยังอาจปรากฏขึ้นอีกด้วย สังเกตจากด้านตรงข้ามของแผ่นทองคำเปลว
ด้วยการนับจำนวนการเรืองแสงวาบต่อหน่วยเวลาในตำแหน่งต่างๆ บนหน้าจอ จึงเป็นไปได้ที่จะสร้างการกระจายตัวของอนุภาคแอลฟาที่กระจัดกระจายในอวกาศได้ จำนวนอนุภาคแอลฟาจะลดลงอย่างรวดเร็วตามมุมการกระเจิงที่เพิ่มขึ้น
ภาพที่สังเกตบนหน้าจอนำไปสู่ข้อสรุปว่าอนุภาคอัลฟาส่วนใหญ่ผ่านแผ่นฟอยล์สีทองโดยไม่มีการเปลี่ยนแปลงทิศทางการเคลื่อนที่ที่เห็นได้ชัดเจน อย่างไรก็ตาม อนุภาคบางส่วนเบี่ยงเบนไปในมุมกว้างจากทิศทางเดิมของอนุภาคแอลฟา (ประมาณ 135โอ...150 โอ ) และยังถูกโยนกลับด้วยซ้ำ การศึกษาพบว่าเมื่ออนุภาคอัลฟาผ่านฟอยล์ ทุก ๆ 10,000 อนุภาคที่ตกกระทบ จะมีเพียงอนุภาคเดียวเท่านั้นที่ถูกเบี่ยงเบนด้วยมุมมากกว่า 10โอ จากทิศทางการเคลื่อนที่เดิม อนุภาคอัลฟาจำนวนมากเบี่ยงเบนไปจากทิศทางเดิมเช่นเดียวกับข้อยกเว้นที่หาได้ยาก
ความจริงที่ว่าอนุภาคแอลฟาจำนวนมากผ่านฟอยล์โดยไม่เบี่ยงเบนไปจากทิศทางการเคลื่อนที่ แสดงให้เห็นว่าอะตอมไม่ใช่ของแข็ง เนื่องจากมวลของอนุภาคอัลฟ่ามากกว่ามวลของอิเล็กตรอนเกือบ 8,000 เท่า อิเล็กตรอนที่รวมอยู่ในอะตอมของฟอยล์จึงไม่สามารถเปลี่ยนอนุภาคอัลฟ่าได้อย่างเห็นได้ชัด การกระเจิงของอนุภาคอัลฟ่าอาจเกิดจากอนุภาคที่มีประจุบวกของอะตอม - นิวเคลียสของอะตอม
IV. การเสริมกำลัง
การพิจารณาตัวอย่าง
วี. การสะท้อน
วันนี้คุณชอบบทเรียนของเราไหม..จำอะไรได้บ้าง..
วี. D/Z ทำซ้ำ §7.1 เรียนรู้ §7.2
Ernest Rutherford เป็นหนึ่งในผู้ก่อตั้งหลักคำสอนพื้นฐานของโครงสร้างภายในของอะตอม นักวิทยาศาสตร์เกิดที่อังกฤษในครอบครัวผู้อพยพจากสกอตแลนด์ รัทเธอร์ฟอร์ดเป็นลูกคนที่สี่ในครอบครัวของเขา และกลายเป็นคนที่มีพรสวรรค์มากที่สุด เขามีส่วนสนับสนุนเป็นพิเศษต่อทฤษฎีโครงสร้างอะตอม
แนวคิดเบื้องต้นเกี่ยวกับโครงสร้างของอะตอม
ควรสังเกตว่าก่อนที่จะมีการทดลองที่มีชื่อเสียงของรัทเธอร์ฟอร์ดเกี่ยวกับการกระเจิงของอนุภาคอัลฟา แนวคิดที่โดดเด่นในเวลานั้นเกี่ยวกับโครงสร้างของอะตอมคือแบบจำลองทอมป์สัน นักวิทยาศาสตร์คนนี้มั่นใจว่าประจุบวกจะเติมปริมาตรอะตอมทั้งหมดอย่างสม่ำเสมอ ทอมป์สันเชื่อว่าอิเล็กตรอนที่มีประจุลบนั้นเหมือนกับว่าสลับกับมัน

ข้อกำหนดเบื้องต้นสำหรับการปฏิวัติทางวิทยาศาสตร์
หลังจากสำเร็จการศึกษา รัทเทอร์ฟอร์ดในฐานะนักเรียนที่มีความสามารถมากที่สุด ได้รับเงินสนับสนุน 50 ปอนด์สำหรับการศึกษาต่อ ด้วยเหตุนี้เขาจึงสามารถเข้าเรียนวิทยาลัยในนิวซีแลนด์ได้ ต่อไป นักวิทยาศาสตร์รุ่นเยาว์ผ่านการสอบที่มหาวิทยาลัยแคนเทอร์เบอรี และเริ่มเรียนฟิสิกส์และเคมีอย่างจริงจัง ในปี พ.ศ. 2434 รัทเทอร์ฟอร์ดได้บรรยายครั้งแรกในหัวข้อ "วิวัฒนาการขององค์ประกอบ" เป็นครั้งแรกในประวัติศาสตร์ที่มีการสรุปแนวคิดที่ว่าอะตอมเป็นโครงสร้างที่ซับซ้อน
ในเวลานั้น ความคิดของดาลตันที่ว่าอะตอมเป็นวงกลมที่แบ่งแยกไม่ได้ครอบงำแวดวงวิทยาศาสตร์ สำหรับทุกคนรอบๆ Rutherford ความคิดของเขาดูเหมือนบ้าไปเลย นักวิทยาศาสตร์รุ่นเยาว์ต้องขอโทษเพื่อนร่วมงานอย่างต่อเนื่องสำหรับ "เรื่องไร้สาระ" แต่หลังจากผ่านไป 12 ปี รัทเทอร์ฟอร์ดยังคงสามารถพิสูจน์ได้ว่าเขาพูดถูก รัทเทอร์ฟอร์ดมีโอกาสทำการวิจัยต่อที่ห้องปฏิบัติการคาเวนดิชในอังกฤษ ซึ่งเขาเริ่มศึกษากระบวนการไอออไนซ์ในอากาศ การค้นพบครั้งแรกของรัทเทอร์ฟอร์ดคือรังสีอัลฟ่าและเบต้า

ประสบการณ์ของรัทเทอร์ฟอร์ด
การค้นพบสามารถอธิบายสั้น ๆ ได้ดังนี้: ในปี 1912 รัทเธอร์ฟอร์ดร่วมกับผู้ช่วยของเขาได้ทำการทดลองที่มีชื่อเสียงของเขา - อนุภาคอัลฟ่าถูกปล่อยออกมาจากแหล่งกำเนิดตะกั่ว อนุภาคทั้งหมด ยกเว้นที่ถูกดูดซับโดยตะกั่ว จะเคลื่อนที่ไปตามช่องที่ติดตั้งไว้ กระแสน้ำแคบ ๆ ของพวกเขาตกลงบนแผ่นฟอยล์บาง ๆ เส้นนี้ตั้งฉากกับแผ่นงาน การทดลองของรัทเทอร์ฟอร์ดเกี่ยวกับการกระเจิงของอนุภาคแอลฟาพิสูจน์ว่าอนุภาคเหล่านั้นที่ผ่านแผ่นฟอยล์ทำให้เกิดแสงแวววาวบนหน้าจอ
หน้าจอนี้ถูกเคลือบด้วยสารพิเศษที่เริ่มเรืองแสงเมื่ออนุภาคอัลฟ่ากระทบ ช่องว่างระหว่างชั้นฟอยล์สีทองและหน้าจอเต็มไปด้วยสุญญากาศเพื่อป้องกันไม่ให้อนุภาคอัลฟ่ากระจายไปในอากาศ อุปกรณ์ดังกล่าวช่วยให้นักวิจัยสังเกตอนุภาคที่กระเจิงได้ที่มุมประมาณ 150°
หากไม่ได้ใช้ฟอยล์เป็นสิ่งกีดขวางหน้าลำแสงอนุภาคอัลฟา ก็จะเกิดวงกลมแสงแวววาวบนหน้าจอ แต่ทันทีที่มีการวางแผงกั้นฟอยล์สีทองไว้ด้านหน้าลำแสง ภาพก็เปลี่ยนไปอย่างมาก แฟลชปรากฏขึ้นไม่เพียงแต่นอกวงกลมนี้เท่านั้น แต่ยังปรากฏที่ด้านตรงข้ามของฟอยล์ด้วย การทดลองของรัทเทอร์ฟอร์ดเกี่ยวกับการกระเจิงของอนุภาคแอลฟาแสดงให้เห็นว่าอนุภาคส่วนใหญ่ผ่านฟอยล์โดยไม่มีการเปลี่ยนแปลงวิถีของพวกมันอย่างเห็นได้ชัด
ในกรณีนี้ อนุภาคบางส่วนเบี่ยงเบนไปในมุมที่ค่อนข้างใหญ่และยังถูกโยนกลับไปด้วยซ้ำ สำหรับอนุภาคทุกๆ 10,000 อนุภาคที่เคลื่อนผ่านชั้นฟอยล์สีทองอย่างอิสระ มีเพียงอนุภาคเดียวเท่านั้นที่ถูกเบี่ยงเบนด้วยมุมที่เกิน 10° - ยกเว้น อนุภาคตัวหนึ่งถูกเบี่ยงเบนด้วยมุมดังกล่าว

สาเหตุที่ทำให้อนุภาคอัลฟ่าเบี่ยงเบนไป
สิ่งที่การทดลองของรัทเทอร์ฟอร์ดตรวจสอบและพิสูจน์โดยละเอียดคือโครงสร้างของอะตอม สถานการณ์นี้บ่งชี้ว่าอะตอมไม่ได้ก่อตัวอย่างต่อเนื่อง อนุภาคส่วนใหญ่ผ่านไปอย่างอิสระผ่านฟอยล์ที่มีความหนาหนึ่งอะตอม และเนื่องจากมวลของอนุภาคอัลฟ่ามากกว่ามวลของอิเล็กตรอนเกือบ 8,000 เท่า มวลอย่างหลังจึงไม่ส่งผลต่อวิถีโคจรของอนุภาคอัลฟ่าอย่างมีนัยสำคัญ สิ่งนี้สามารถทำได้โดยนิวเคลียสของอะตอมเท่านั้นซึ่งเป็นวัตถุขนาดเล็กซึ่งมีมวลเกือบทั้งหมดและมีประจุไฟฟ้าทั้งหมดของอะตอม ในเวลานั้นสิ่งนี้กลายเป็นความก้าวหน้าครั้งสำคัญสำหรับนักฟิสิกส์ชาวอังกฤษ ประสบการณ์ของรัทเทอร์ฟอร์ดถือเป็นขั้นตอนที่สำคัญที่สุดประการหนึ่งในการพัฒนาวิทยาศาสตร์เกี่ยวกับโครงสร้างภายในของอะตอม
การค้นพบอื่นๆ ที่เกิดขึ้นระหว่างการศึกษาอะตอม
การศึกษาเหล่านี้ให้หลักฐานโดยตรงว่าประจุบวกของอะตอมอยู่ภายในนิวเคลียสของมัน พื้นที่นี้ใช้พื้นที่น้อยมากเมื่อเทียบกับขนาดโดยรวม ในปริมาตรที่น้อยเช่นนี้ การกระเจิงของอนุภาคแอลฟาจึงไม่น่าเป็นไปได้อย่างยิ่ง และอนุภาคเหล่านั้นที่ผ่านไปใกล้บริเวณนิวเคลียสของอะตอมก็เกิดการเบี่ยงเบนอย่างรุนแรงจากวิถีโคจร เนื่องจากแรงผลักระหว่างอนุภาคแอลฟาและนิวเคลียสของอะตอมนั้นทรงพลังมาก การทดลองการกระเจิงของอนุภาคแอลฟาของรัทเทอร์ฟอร์ดได้พิสูจน์ความเป็นไปได้ที่อนุภาคแอลฟาจะชนนิวเคลียสโดยตรง จริงอยู่ ความน่าจะเป็นมีน้อยมาก แต่ก็ยังไม่เป็นศูนย์
นี่ไม่ใช่ข้อเท็จจริงเดียวที่ประสบการณ์ของรัทเทอร์ฟอร์ดได้รับการพิสูจน์แล้ว เพื่อนร่วมงานของเขาได้ศึกษาโครงสร้างของอะตอมโดยสังเขป ซึ่งได้ค้นพบที่สำคัญอื่นๆ อีกหลายประการ ยกเว้นการสอนว่าอนุภาคแอลฟาเป็นนิวเคลียสฮีเลียมที่เคลื่อนที่เร็ว
นักวิทยาศาสตร์สามารถอธิบายโครงสร้างของอะตอมที่นิวเคลียสครอบครองส่วนเล็กๆ ของปริมาตรทั้งหมดได้ การทดลองของเขาพิสูจน์ว่าประจุเกือบทั้งหมดของอะตอมมีความเข้มข้นอยู่ภายในนิวเคลียสของมัน ในกรณีนี้ ทั้งสองกรณีของการโก่งตัวของอนุภาคอัลฟ่าและการชนกับนิวเคลียสเกิดขึ้น

การทดลองของรัทเธอร์ฟอร์ด: แบบจำลองนิวเคลียร์ของอะตอม
ในปีพ.ศ. 2454 รัทเทอร์ฟอร์ดหลังจากการศึกษาจำนวนมาก ได้เสนอแบบจำลองโครงสร้างของอะตอมซึ่งเขาเรียกว่าดาวเคราะห์ ตามแบบจำลองนี้ ภายในอะตอมจะมีนิวเคลียสที่บรรจุมวลอนุภาคเกือบทั้งหมด อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสในลักษณะเดียวกันกับที่ดาวเคราะห์เคลื่อนที่รอบดวงอาทิตย์ จากการรวมกันของพวกมันจะเกิดสิ่งที่เรียกว่าเมฆอิเล็กตรอน อะตอมมีประจุเป็นกลาง ดังที่การทดลองของรัทเทอร์ฟอร์ดแสดงให้เห็น
โครงสร้างของอะตอมในเวลาต่อมากลายเป็นที่สนใจของนักวิทยาศาสตร์ชื่อนีลส์ บอร์ เขาเป็นผู้สรุปการสอนของรัทเทอร์ฟอร์ด เพราะก่อนที่แบบจำลองอะตอมของดาวเคราะห์ของบอร์จะเริ่มประสบปัญหาในการอธิบาย เนื่องจากอิเล็กตรอนเคลื่อนที่ไปรอบนิวเคลียสในวงโคจรที่แน่นอนด้วยความเร่ง ไม่ช้าก็เร็วมันจะต้องตกเข้าสู่นิวเคลียสของอะตอม อย่างไรก็ตาม นีลส์ บอร์สามารถพิสูจน์ได้ว่าภายในอะตอม กฎของกลศาสตร์คลาสสิกใช้ไม่ได้อีกต่อไป
ข้อสรุปจากการทดลองการกระเจิงอนุภาคแอลฟาของรัทเทอร์ฟอร์ด: 1. มีนิวเคลียสของอะตอม กล่าวคือ วัตถุขนาดเล็กที่มีมวลเกือบทั้งหมดของอะตอมและประจุบวกทั้งหมดกระจุกตัวอยู่ 2. มวลเกือบทั้งหมดของอะตอมกระจุกตัวอยู่ในนิวเคลียส 3. อนุภาคเชิงลบ - อิเล็กตรอน - หมุนรอบนิวเคลียสในวงโคจรปิด 4. ประจุลบของอิเล็กตรอนทั้งหมดจะกระจายไปทั่วทั้งปริมาตรของอะตอม แบบจำลองนิวเคลียร์ของอะตอม:
สไลด์ 9จากการนำเสนอ “การทดลองของรัทเทอร์ฟอร์ด แบบจำลองอะตอม”. ขนาดของไฟล์เก็บถาวรพร้อมการนำเสนอคือ 174 KBฟิสิกส์ ชั้นประถมศึกษาปีที่ 9
สรุปการนำเสนออื่นๆ“โครงสร้างของอะตอมของธาตุ” - ผู้ค้นพบปรากฏการณ์กัมมันตภาพรังสี โครงสร้าง. อะตอมคือ "แบ่งแยกไม่ได้" รัทเทอร์ฟอร์ดทำการทดลองหลายครั้งเพื่อศึกษาโครงสร้างและองค์ประกอบของอะตอม ทอมสันเสนอแบบจำลองโครงสร้างของอะตอมรุ่นแรกๆ ในปี พ.ศ. 2446 Henri Becquerel ค้นพบปรากฏการณ์กัมมันตภาพรังสี อนุภาคทำให้เกิดแสงวาบบนหน้าจอ สองเหตุการณ์ในช่วงปลายศตวรรษที่ 19 นำไปสู่แนวคิดเรื่องโครงสร้างอะตอมที่ซับซ้อน โครงสร้างของอะตอม แบบจำลองดาวเคราะห์ (นิวเคลียร์)
"ห้องคลาวด์" - วัตถุประสงค์ของอุปกรณ์ หลักการของหุ่นยนต์ การปรับปรุง. ความจุ. ผู้ประดิษฐ์อุปกรณ์ ความหมาย. กล้อง. วิลสัน. ห้องวิลสัน. อุปกรณ์.
“ความปลอดภัยของพลังงานนิวเคลียร์” - จากประวัติศาสตร์พลังงานนิวเคลียร์ ปฏิกิริยาการสลายตัวของนิวเคลียสยูเรเนียม แผนภาพแสดงการทำงานของเครื่องปฏิกรณ์นิวเคลียร์ที่กำลังเดือด ความปลอดภัย. แผนผังของเครื่องปฏิกรณ์นิวเคลียร์ที่กำลังเดือด โรงไฟฟ้านิวเคลียร์มีความสามารถในการผลิตพลังงานมากขึ้น โรงไฟฟ้านิวเคลียร์. อันตรายจากพลังงานนิวเคลียร์ โรงไฟฟ้านิวเคลียร์บนแผนที่ของรัสเซีย เครื่องปฏิกรณ์นิวเคลียร์ พลังงานนิวเคลียร์. ฟิวชั่นเทอร์โมนิวเคลียร์ ประโยชน์และโทษของพลังงานนิวเคลียร์ เรือตัดน้ำแข็งนิวเคลียร์
“ฟิสิกส์ “การเคลื่อนไหว”” - ปฏิสัมพันธ์ของร่างกาย กลศาสตร์. กฎการอนุรักษ์ในกลศาสตร์ โครงสร้างของอะตอม ความเฉื่อยและมวลของร่างกาย ความเร็วระหว่างการเคลื่อนไหวที่ไม่สม่ำเสมอ พิกัดเปลี่ยนแปลงอย่างไร การเคลื่อนไหวระหว่างการเคลื่อนที่ด้วยความเร่งสม่ำเสมอเป็นเส้นตรง พื้นฐานของไดนามิก งานแห่งกำลัง. กฎข้อที่ 2 ของนิวตัน การล้มของร่างกายอย่างอิสระ พื้นฐานของฟิสิกส์ ศึกษาคุณสมบัติของสสาร เวกเตอร์ กฎข้อที่ 3 ของนิวตัน ระยะเวลาและความถี่ของการไหลเวียน การเร่งความเร็ว ฟิสิกส์เป็นวิทยาศาสตร์ที่แน่นอน
“การแกว่งของลูกตุ้มทางคณิตศาสตร์” - แผนการสอน การใช้การแกว่งของลูกตุ้มในทางปฏิบัติ กาลิเลโอ กาลิเลอี (ค.ศ. 1564-1642) ฮอยเกนส์ คริสเตียน (1629 – 1695) ร่างกายใดก็ตามสามารถเคลื่อนไหวแบบแกว่งไปมาได้ การทดลองทำเป็นวงกลมแคบๆ ภาพประกอบการสั่นสะเทือนทางกลโดยใช้ตัวอย่างของลูกตุ้มฟูโกต์ อาคารเก่าของมหาวิทยาลัยปิซา ลูกตุ้มจริงถือได้ว่าเป็นคณิตศาสตร์หากความยาวของด้ายมากกว่าขนาดของลำตัวที่แขวนอยู่มาก
“ First Cosmic Velocity” - แก้ปัญหา ความเร่งของการตกอย่างอิสระ ความเร็วที่ต้องมอบให้กับวัตถุจึงจะกลายเป็นดาวเทียม ความรู้เบื้องต้นเกี่ยวกับดาวเทียมประดิษฐ์ ความเร็วหลบหนีครั้งแรก เงื่อนไขที่ร่างกายกลายเป็นปัญญาประดิษฐ์ ดาวเทียมโลกเทียม กำหนดความเร็วหนีแรกสำหรับการปล่อยดาวเทียม แก้ปัญหา. การปฏิวัติของดาวเคราะห์รอบดวงอาทิตย์