การติดเชื้อ Reoviral ในไก่ (tenosinovinis ของไวรัสในไก่, tenosynovitis reoviral) เป็นโรคติดต่อจากไวรัสในนกโดยมีอาการท้องร่วง tenosynovitis และโรคข้ออักเสบ
สาเหตุสาเหตุของโรคคือไวรัสที่มี RNA ของตระกูล Reoviridae ไวรัสสามารถคงอยู่ในสิ่งมีชีวิตที่ติดเชื้อเป็นเวลานาน เพาะเลี้ยงในตัวอ่อนไก่ และในการเพาะเลี้ยงเซลล์ของไตของไก่ด้วยการก่อตัวของซินเธีย
ระบาดวิทยา.ไก่และแม่ไก่ป่วย แหล่งที่มาของการติดเชื้อคือนกพาหะไวรัสที่ป่วยและหายดีแล้ว (พาหะไวรัสดำเนินต่อไปอีก 289 วัน) การติดเชื้อเกิดขึ้นผ่านทางทางเดินอาหารเช่นเดียวกับทาง transovarially การแพร่กระจายของไวรัสเกิดขึ้นผ่านไข่ฟักที่ได้รับจากทั้งนกที่ป่วยและฟื้นตัว ปัจจัยการแพร่กระจายของเชื้อโรค ได้แก่ มูลสัตว์ที่ติดเชื้อ น้ำ อาหาร สินค้าคงคลัง และอุปกรณ์ดูแลรักษา อัตราการเสียชีวิตสามารถเข้าถึง 30% โดยมีอุบัติการณ์ 100%
การเกิดโรคไวรัสจะเพิ่มจำนวนในเซลล์เยื่อบุผิวของลำไส้ทำให้เกิดการพัฒนาของลำไส้อักเสบจากหวัด, เยื่อบุช่องท้องอักเสบจากไข่แดง ต่อมารังไข่ฝ่อและการก่อตัวของรูขุมขนน้ำเหลืองในเส้นเอ็นเกิดขึ้น
อาการและแน่นอนระยะฟักตัว 2-7 วัน โรคนี้จะรุนแรงในไก่และเรื้อรังในไก่โตเต็มวัย การติดเชื้อจะมาพร้อมกับการอุดตันของเสื้อคลุมทำให้ผลผลิตเนื้อสัตว์ลดลง ไวรัสซ้ำอาจทำให้เกิดอาการท้องร่วง ภาวะขาดน้ำ โลหิตจาง ขนไม่ดี และอาการอื่นๆ
ลูกไก่เนื้อ ซึ่งโดยปกติจะอายุ 5 สัปดาห์ และแม่ไก่ไข่อายุ 9 ถึง 10 เดือนจะพัฒนาเนื้องอกเอ็นกล้ามเนื้อข้อเท้าทั้งสองข้าง นกเริ่มเดินกะโผลกกะเผลกไก่และแม่ไก่เคลื่อนไหวด้วยความยากลำบากมาก ด้วยโรคระยะยาวจากรูปแบบเฉียบพลันไปสู่โรคเรื้อรังจะสังเกตเห็นการแตกของเส้นเอ็นข้อเท้า โรคข้ออักเสบมักเกิดขึ้น
การเปลี่ยนแปลงทางพยาธิวิทยาเมื่อเปิดนกที่ตายแล้วจะเผยให้เห็นการปรากฏตัวของ tenosynovitis, โรคข้ออักเสบ, ลำไส้อักเสบจากโรคหวัด - แผล, โรคจมูกอักเสบจากโรคหวัด, กล่องเสียงอักเสบและปรากฏการณ์ของโรคโลหิตจางทั่วไป
การจำแนกลักษณะของไวรัสรีโอไวรัสในนก
reoviruses ของนก: สกุล Orthoreoviruses ( ออร์โธรีโอไวรัส) คือไวรัสที่มี RNA ที่ไม่ห่อหุ้มซึ่งเป็นของครอบครัว รีโอวิริแด. Virion มีขนาด 70-80 นาโนเมตร รูปร่างคล้ายไอโคซาฮีดรัล จีโนม double helix RNA มี 10-12 ส่วน จีโนมเข้ารหัสโปรตีนโครงสร้างแปดชนิด (แลม A, แลมบ์, แลมซี, μA, μB, ซิกเอ, ซิกบี, ซิกซี) และโปรตีนที่ไม่ใช่โครงสร้างสี่ชนิด (μNS, P10, P17, σNS) สถานที่ที่มีการจำลองแบบหลักของไวรัสนกคือเซลล์เยื่อบุผิวของลำไส้เล็กและเบอร์ซาของฟาบริซิอุส ซึ่งไวรัสแพร่กระจายไปยังอวัยวะและเนื้อเยื่อทั้งหมดภายใน 24-48 ชั่วโมงหลังการติดเชื้อ Reoviruses ทำให้เกิดโรคจำนวนมากในนกสายพันธุ์ต่างๆ ในไก่และไก่งวง การติดเชื้อรีโอไวรัสจะเกิดขึ้นพร้อมกับการพัฒนาของโรคข้ออักเสบ/เทนโนซิโนอักเสบ ในไก่ยังมีข้อสังเกตถึงการพัฒนาของกล้ามเนื้อหัวใจอักเสบ, ตับอ่อนอักเสบ, โรคตับอักเสบและลำไส้อักเสบด้วย ในนกแก้วและห่าน การติดเชื้อไวรัสซ้ำทำให้เกิดโรคตับอักเสบและม้ามอักเสบแบบเนื้อตาย
Reoviruses ถูกแยกออกจากนกที่มีสุขภาพดีและป่วย ซึ่งมักเกิดการติดเชื้อร่วมกับโรคทุติยภูมิอื่นๆ จำนวนมาก ซึ่งต้องมีการวิเคราะห์ความสำคัญทางคลินิกของการติดเชื้อที่ตรวจพบแต่ละครั้งอย่างละเอียดถี่ถ้วน
คุณสมบัติของการติดเชื้อในคอร์วิด
Reoviruses (Avian reovirus ARV) เป็นสาเหตุของโรคคอร์วิดที่พบบ่อยและมีอัตราการเสียชีวิตสูง รายงานการติดเชื้อในอเมริกาเหนือในนกกาอเมริกัน Corvus brachyrhynchos(สหรัฐอเมริกา, แคนาดา); ในยุโรป - ที่อีกาสีเทา คอร์วัส โคโรนา คอร์นิกซ์(ฟินแลนด์) อีกาดำ คอร์วัส โคโรน(เบลเยียม) อีกาทั่วไป Corvus monedula(โปแลนด์). ในความเป็นธรรมต้องบอกว่าในยุโรปและในประเทศ CIS ไม่มีการเฝ้าระวังโรคของนกป่าอย่างแข็งขันเช่นเดียวกับที่ทำในอเมริกาเหนือ ดังนั้นจึงมีข้อมูลจริงน้อยมากเกี่ยวกับการแพร่กระจายของ epizootics ของ reoviruses ใน corvids ในยุโรปและโดยเฉพาะในรัสเซีย .
Corvids มีความไวต่อไวรัส West Nile Virus (WNV) มาก ดังนั้นในยุโรปและอเมริกาเหนือ Corvids ในป่าจึงทำหน้าที่เป็น "ตัวบ่งชี้ตามธรรมชาติ" ของการพัฒนาของโรคระบาดที่เกิดจาก flaviviruses ( ฟลาวิวิริแด); ในการศึกษา epizootics ที่เกิดจากไวรัสเวสต์ไนล์ นักวิจัยค้นพบว่าอาการทางระบบประสาทที่คล้ายกัน (ไม่สามารถบินได้, ชัก, คอร์ติคอลลิส, ขาดการตอบสนองต่อวิธีการของคนและสัตว์เลี้ยง) ในคอร์วิดก็เกิดจากไวรัสรีโอเช่นกัน ซึ่งคอร์วิดกลับกลายเป็นว่าไวต่อความรู้สึกมาก ดังนั้นการศึกษาไวรัสตัวหนึ่งจึงค้นพบโรคที่ไม่รู้จักมาก่อนในคอร์วิดป่า
Reovirus ในนกกางเขนทั่วไป
ด้านล่างนี้เป็นคำอธิบายโดยละเอียดเกี่ยวกับการตรวจนกกางเขนสามัญที่ตายแล้ว ( พิก้า พิก้า) ในประเทศอังกฤษที่ตรวจพบการติดเชื้อไวรัสรีโอไวรัส
สภาพของนกป่วย
พบนกกางเขน (ตัวเมียโตเต็มวัย) ตายโดยไม่มีอาการชัดเจน นกตัวนี้เสียชีวิตไม่นานหลังจากที่นักฟื้นฟูหยิบมันขึ้นมา Patkartina ในการชันสูตรพลิกศพมีดังนี้: อ่อนเพลีย - ลดมวลกล้ามเนื้อหน้าอกลงอย่างมาก, ขาดไขมันใต้ผิวหนัง; ผิวหนังเชื่อมต่อกับเนื้อเยื่อใต้ผิวหนังอย่างแน่นหนาซึ่งเป็นสัญญาณของการขาดน้ำ ขนหางและขนบินอยู่ในสภาพที่ไม่ดี กระดูกสันหลังหักจำนวนมาก และเส้นความเครียดหลายเส้นบ่งชี้ว่าเป็นโรคเรื้อรัง
สัญญาณทางกายวิภาคพยาธิวิทยา (patkartina)
ตับ: ขยายใหญ่ขึ้นอย่างเห็นได้ชัด (ตับโต) โดยมีขอบโค้งมน มีเนื้อเยื่อสีส้มและมีรอยโรคไม่มีสี ม้ามขยายใหญ่ขึ้น (ม้ามโต) โดยมีอาการตกเลือดหลายจุด ไม่พบ Bursa of Fabricius ปอดเต็มไปด้วยเลือดทั้งสองข้าง ถุงลมและเยื่อหุ้มหัวใจมีสีเหลืองอ่อน หนาเล็กน้อยและทึบแสง ในช่องปากจะเน้นเป็นสีครีมอ่อนเป็นวงกว้าง มีความสม่ำเสมอหลวม ติดอยู่กับเยื่อเมือกของเพดานปาก และขยายไปจนถึงส่วนล่างของช่องปากรอบลิ้น กระเพาะอาหารของต่อมและกล้ามเนื้อว่างเปล่า พบไคม์เหลวในปริมาณปานกลางที่เปื้อนเลือดในลำไส้เล็กหลอดเลือดของน้ำเหลืองเต็มไปด้วยเลือดอย่างมาก ลำไส้ใหญ่มีสารสีน้ำตาลเข้มสีซีดจางในปริมาณปานกลาง ต่อมหมวกไตขยายใหญ่ขึ้นและมองเห็นได้ชัดเจน หลอดเลือดสมองเต็มไปด้วยเลือด
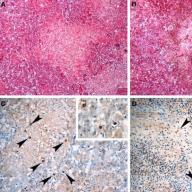
ตับของนกขุนแผนที่เสียชีวิตจากการติดเชื้อไวรัสรีโอไวรัสในการชันสูตรพลิกศพ ภาพทางพยาธิวิทยาทางกายวิภาคของตับ, การเปลี่ยนแปลงสีของตับ, จุดโฟกัสของเนื้อร้ายของ miliary หัวใจ: เยื่อหุ้มหัวใจอักเสบ
การวิเคราะห์ทางแบคทีเรีย
ในระหว่างการวิเคราะห์ทางแบคทีเรียวิทยาของตับ ปริมาณในลำไส้ และการวางตัวจากช่องปาก วัฒนธรรมบริสุทธิ์จะถูกแยกออกจากเนื้อเยื่อของตับและในลำไส้ การเพาะเลี้ยงในสภาพแวดล้อมแบบไม่ใช้ออกซิเจนไม่เผยให้เห็นสัญญาณของคลอสตริเดีย ( คลอสตริเดียม เอสพีพี.). การย้อมสีรอยเปื้อนตับของ Ziehl-Neelsen ไม่ได้เผยให้เห็นสิ่งมีชีวิตที่เป็นกรดอย่างรวดเร็ว
การวิเคราะห์ทางจุลพยาธิวิทยา
ชิ้นส่วนของอวัยวะภายในถูกวางในสารละลายฟอร์มาลินบัฟเฟอร์ที่เป็นกลาง 10% หลังจากนั้นจึงเตรียมการตรวจชิ้นเนื้อตามแผนมาตรฐาน นอกเหนือจากการย้อมสีมาตรฐานของการเตรียมเนื้อเยื่อวิทยาด้วย Hematoxylin-Eosin แล้ว การเตรียมเนื้อเยื่อยังถูกย้อมเพิ่มเติมตาม Giemsa, Gram, Prussian Blue ของ Perls, Schiff (Periodic Acid-Schiff) และ Ziehl-Neelsen
การวิเคราะห์ทางจุลพยาธิวิทยาเผยให้เห็นพื้นที่กว้างขวางของโรคตับอักเสบเฉียบพลันที่ไหลมารวมกันซึ่งเกี่ยวข้องกับการสะสมของเฮโมซิเดริน (ตรวจพบโดยคราบสีน้ำเงินปรัสเซียนของ Perls) โซนของเนื้อร้ายในตับมีขนาดค่อนข้างใหญ่ (ซึ่งอาจนำไปสู่การตายของนกเนื่องจากตับวาย) นอกจากนี้ยังพบท่อน้ำดีอักเสบปานกลางที่เกิดจากการอุดตันของท่อน้ำดีด้วยแรงสั่นสะเทือน ม้าม: มาบรรจบกัน, เนื้อร้ายโฟกัสเฉียบพลันของเยื่อกระดาษ, อาการบวมน้ำ, จุดโฟกัสของการตกเลือดในเนื้อเยื่อ, ฝ่อต่อมน้ำเหลืองกระจาย ต่อมหมวกไต: แพร่กระจายเยื่อหุ้มสมอง hyperplasia ไม่พบรอยโรคในเนื้อเยื่อสมอง

การเตรียมเนื้อเยื่อตับและม้ามทางจุลพยาธิวิทยาของนกกางเขนที่เสียชีวิตจากการติดเชื้อรีโอไวรัส A. จุดสนใจของการตายของเซลล์ตับเฉียบพลันที่ไหลมารวมกัน การย้อมสีเฮมาทอกซิลิน-อีโอซิน กำลังขยาย 200. B. เนื้อร้ายไฟบรินของม้าม การย้อมสีเฮมาทอกซิลิน-อีโอซิน กำลังขยาย 200.
ซีดี. การสาธิต RNA ของไวรัสนกในระหว่างการผสมพันธุ์ในเซลล์ (ลูกศร) จากรอยโรคในตับ (C) และม้าม (D)
ที่มา: Lawson B., Dastjerdi A., Shah S., Everest D., Núñez A., Pocknell A., Hicks D., Horton D.L., Cunningham A.A., Irvine R.M.: อัตราการตายที่เกี่ยวข้องกับการติดเชื้อ reovirus ในสัตว์ปีกในสิ่งมีชีวิตอิสระ นกกางเขน (Pica pica) ในบริเตนใหญ่ BMC Vet Res 2015, 11, 20, ดอย: 10.1186/s12917-015-0329-5
การทดสอบทางไวรัสวิทยา
เนื้อเยื่อสมองและไตของ Magpie ได้รับการตรวจโดย PCR โดยใช้ไพรเมอร์สำหรับไวรัส West Nile และไพรเมอร์ทั่วไปของ flaviviruses ผลลัพธ์ที่ได้เป็นลบ ตรวจเนื้อเยื่อของไตและม้ามโดย PCR เพื่อดูว่ามีสารพันธุกรรมที่พบได้ทั่วไปในไวรัสเริมหรือไม่ - ผลลัพธ์เป็นลบ
ตรวจสอบเนื้อเดียวกันของเนื้อเยื่อตับและเนื้อหาของลำไส้เล็กโดยใช้กล้องจุลทรรศน์อิเล็กตรอนชนิดคอนทราสต์เชิงลบซึ่งเผยให้เห็นการมีอยู่ของอนุภาคไวรัสที่มีขนาด 77-78 นาโนเมตร รูปร่างของ virions ในทั้งสองตัวอย่างสอดคล้องกับ reoviruses

ภาพไมโครกราฟอิเล็กตรอนแบบถ่ายทอดได้ของรีโอไวรัสที่แยกได้จากเนื้อเยื่อตับนกกางเขนระหว่างการเพาะเลี้ยง ลาย 100 นาโนเมตร
ที่มา: Lawson B., Dastjerdi A., Shah S., Everest D., Núñez A., Pocknell A., Hicks D., Horton D.L., Cunningham A.A., Irvine R.M.: อัตราการตายที่เกี่ยวข้องกับการติดเชื้อ reovirus ในสัตว์ปีกในสิ่งมีชีวิตอิสระ นกกางเขน (Pica pica) ในบริเตนใหญ่ BMC Vet Res 2015, 11, 20, ดอย: 10.1186/s12917-015-0329-5
การวินิจฉัยระดับโมเลกุล
หลังจากนั้น การวิเคราะห์ PCR ของเนื้อเยื่อตับและม้ามดำเนินการด้วยไพรเมอร์ของส่วน L2 ของจีโนมที่พบได้ทั่วไปในไวรัสรีโอไวรัส ปฏิกิริยาต่อยีน L2 ของ reoviruses (RNA polymerase ที่ขึ้นกับ RNA - ประมาณ 274 เบส) เป็นผลบวก
นอกจากนี้ไวรัสยังถูกแยกออกจากเนื้อเยื่อของตับ ไต เนื้อหาของลำไส้เล็กในการเพาะเลี้ยงเซลล์ ในทั้งสองกรณี (วัสดุจากไต / ตับและเนื้อหาของลำไส้เล็ก) ตรวจพบผลทางไซโตพาติก กล้องจุลทรรศน์อิเล็กตรอนของการเพาะเลี้ยงเนื้อเยื่อเผยให้เห็นอนุภาคของไวรัสคล้ายกับที่พบในเนื้อเยื่อตับตามธรรมชาติและในลำไส้เล็ก
การศึกษาอิมมูโนฮิสโตเคมีของเนื้อเยื่อตับและม้ามโดยใช้การใช้การผสมพันธุ์แบบ in-situ ได้ดำเนินการ ซึ่งเผยให้เห็นการสะสมที่โดดเด่นของอนุภาคไวรัสในบริเวณเนื้อร้ายและเนื้อเยื่อที่อยู่ติดกัน (ดูรูปการเตรียมเนื้อเยื่อวิทยา)
ต้นไม้สายวิวัฒนาการของไวรัสที่สร้างขึ้นจากการวิเคราะห์กรดอะมิโนของโปรตีน C จำนวน 285 ตัว พบว่าไวรัสที่แยกได้จากนกกางเขนนั้นอยู่ใกล้กับรีโอไวรัสไก่ที่แยกได้ในอินเดีย สหรัฐอเมริกา และจีน และค่อนข้างห่างไกลจาก รีโอไวรัสไก่ที่แยกได้ในทวีปยุโรป
การติดเชื้อทุติยภูมิและข้อสรุป
ตับและม้ามของนกกางเขนนี้ได้รับผลกระทบในลักษณะเดียวกับที่อธิบายไว้สำหรับนกแก้วที่ติดเชื้อรีโอไวรัส โรคไขสันหลังอักเสบที่เนื้อตายมักอธิบายไว้ในอีกาที่มีไวรัสรีโอไวรัส ในคอร์วิด มักมีการอธิบายอาการทางระบบประสาท นกกางเขนตัวนี้ไม่สามารถบินได้เมื่อพบ แต่ไม่พบร่องรอยของความเสียหายต่อระบบประสาทส่วนกลาง ยกเว้นเส้นเลือดในสมองที่เต็มไปด้วยเลือด ค้นพบ. การพร่องของน้ำเหลืองและผลที่ตามมาคือ การกดภูมิคุ้มกันและการพัฒนาของโรคแบคทีเรียและเชื้อราทุติยภูมิในนก มักถูกอธิบายด้วยสัญญาณของการติดเชื้อรีโอไวรัส เนื่องจากการตรวจทางจุลพยาธิวิทยาไม่ได้เผยให้เห็นโคโลนีของแบคทีเรียที่แพร่กระจายหรือกระบวนการอักเสบที่เด่นชัด หมายความว่าการแยกเชื้อ E. coli ออกจากอวัยวะต่างๆ และสิ่งที่อยู่ในลำไส้มักบ่งชี้ถึงการบุกรุกของแบคทีเรียหลังการชันสูตร มากกว่าการติดเชื้อทั่วร่างกายที่แพร่กระจาย
ความใกล้ชิดของจีโนมของรีโอไวรัสที่แยกได้ในนกกางเขนกับรีโอไวรัสของไก่ในอเมริกาเหนือ อินเดีย อิสราเอล และจีน แต่ยังไม่ชัดเจนกับจีโนมของรีโอไวรัสที่แยกได้จากไก่ในยุโรปตะวันตกเฉียงเหนือ นอกจากนี้ยังชี้ให้เห็นว่าคอร์วิดป่าสามารถติดเชื้อจากนกพันธุ์อุตสาหกรรมในฟาร์มสัตว์ปีกได้
ความตายของอีกาอเมริกัน ( Corvus brachyrhynchos) จากการติดเชื้อไวรัสรีโอไวรัสในประเทศแคนาดา
การติดเชื้อดำเนินไปอย่างรวดเร็ว นกที่ตายแล้วส่วนใหญ่ได้รับการเลี้ยงดูอย่างดีโดยไม่มีอาการอ่อนเพลีย สัญญาณทางพยาธิวิทยาที่เห็นได้ชัดเจนที่สุดคือการอักเสบของเลือดออกในลำไส้เล็ก ในกาที่ตายแล้วบางกาพบว่ามีม้ามอักเสบร่วมกับจุดโฟกัสของเนื้อร้ายเนื้อเยื่อ
นกเหล่านี้ได้รับการทดสอบเพื่อหาไวรัสเวสต์ไนล์ ซึ่งเป็นตัวฆ่าคอร์วิดที่พบบ่อยในอเมริกาเหนือ และสำหรับโรคไข้หวัดนก ซึ่งทั้งหมดมีผลเป็นลบ การวิเคราะห์ทางแบคทีเรียไม่พบสารติดเชื้อใดๆ ในอีกาที่ตายแล้ว การชันสูตรพลิกศพไม่มีอาการเป็นพิษ
การตรวจเนื้อเยื่อของตับ ม้าม ไต และลำไส้ ล้วนเป็นผลบวกต่อการติดเชื้อรีโอไวรัส การวิเคราะห์แบบใดไม่ได้ระบุไว้ในหมายเหตุ
ตั้งแต่ปี 2000 ตามข้อมูลของศูนย์สุขภาพสัตว์ป่าแห่งชาติ (NWHC USGS Madison Wi.) พบว่ากาอเมริกันเสียชีวิตจากไวรัสรีโอไวรัสในส่วนต่างๆ ของสหรัฐอเมริกา

โรคริดสีดวงทวารในนกกาอเมริกัน ( Corvus brachyrhynchos) ซึ่งเสียชีวิตจากการสร้างการติดเชื้อไวรัสซ้ำอีกครั้ง
โรคของไก่งวง (หวีสีน้ำเงิน, ลำไส้อักเสบติดเชื้อ, ลำไส้อักเสบติดต่อ, โรคไตอักเสบจากไวรัส), ไก่และแม่ไก่ (tenosynovitis, โรคข้ออักเสบจากไวรัส, "อาหารไม่ย่อย" และกลุ่มอาการ "นกสีซีด") ลูกเป็ดและห่าน แสดงออกโดยอาการที่หลากหลายที่ซับซ้อนและทำให้เกิด ความเสียหายทางเศรษฐกิจที่สำคัญ
รีโอไวรัสในนกมีความทนทานต่อแสงอัลตราไวโอเลต ไม่ถูกปิดใช้งานในช่วง pH ที่กว้าง และค่อนข้างไวต่อสารฆ่าเชื้อทั่วไป ไอของฟอร์มาลดีไฮด์ไม่ทำให้เป็นกลางบนพื้นผิวของเปลือกไข่ฟัก ลูกไก่อาจติดเชื้อไวรัสได้เมื่อจิกที่ฟัก
Reoviruses แพร่กระจายได้ดีในเอ็มบริโอไก่และไก่งวง การเพาะเลี้ยงเซลล์ไฟโบรบลาสต์ของไก่ หรือการเพาะเลี้ยงเซลล์ไตของนก ภายใต้สภาวะทางธรรมชาติ มีการตรวจพบแอนติบอดีต่อการติดเชื้อไวรัสซ้ำในสัตว์ปีกในประเทศต่างๆ
แหล่งที่มาหลักของการติดเชื้อคือนกป่วยและสิ่งขับถ่ายของมัน เมื่ออยู่ในอุจจาระ ไวรัสจะเข้าสู่สิ่งแวดล้อมและทำให้อาหารและน้ำติดเชื้อ
ภาพทางคลินิก
ในวันที่ 5 สัตว์เล็กที่ป่วยจะมีอาการท้องเสีย ซึมเศร้า และเสียชีวิตมากถึง 5% ขึ้นไป ไก่งวงและลูกห่านที่รอดชีวิตอาจทำให้เกิดโรคไซนัสอักเสบในช่องปาก เยื่อบุตาอักเสบ โรคนี้กลายเป็นเรื้อรังการเติบโตของเด็กยังล้าหลังในการพัฒนา เมื่ออายุได้สามสัปดาห์ไก่จะพัฒนา tenosynovitis ซึ่งมีการตั้งค่าขาที่ไม่ถูกต้องความอ่อนแอ ในกลุ่มที่ไม่เอื้ออำนวยต่อการติดเชื้อ reovirus ความหลากหลายในการพัฒนาของสัตว์เล็กนั้นเด่นชัดสัญญาณที่พบบ่อยคือ "การทำให้แห้ง" ของซากเนื่องจากความอร่อยและการย่อยได้ของอาหารสัตว์ลดลง
เมื่อนกติดเชื้อ reovirus ใน 10-30 วันโรคจะรุนแรงน้อยลงของเสียไม่เกิน 1.5-5% อย่างไรก็ตามไม่ได้รับผลผลิตตามแผนจากนกดังกล่าว
การสูญเสียที่สำคัญที่สุดในระยะเฉียบพลันของการติดเชื้อไวรัสซ้ำนั้นพบได้ในสัตว์ปีกที่ผลิตเนื้อลูกอ่อน: 5-18% ในไก่เนื้อ, 50% ในไก่งวงและลูกห่าน และมากถึง 100% ในลูกเป็ด
ตามธรรมชาติของการติดเชื้อจะสังเกตเห็นอาการบวมน้ำของปลอกเอ็นและการตกเลือดในโพรงของข้อต่อที่ได้รับผลกระทบ ในระยะเรื้อรังของโรคความหนาของปลอกเอ็นการคายน้ำ ankylosis ของข้อต่อจะถูกเปิดเผยการแตกของเอ็นฝ่อเป็นไปได้
พยาธิสัณฐานวิทยา
ในระยะที่ไม่ซับซ้อนของโรคจะมีอาการลำไส้อักเสบจากโรคหวัดซึ่งมีการเพิ่มขึ้นของไต กล้ามเนื้อขาดน้ำ อยู่ในภาวะเสื่อม
การวินิจฉัย
การวินิจฉัยขึ้นอยู่กับข้อมูลทางระบาดวิทยา อาการทางคลินิก การเปลี่ยนแปลงทางพยาธิวิทยา และผลการตรวจทางห้องปฏิบัติการ สำหรับการวินิจฉัยทางห้องปฏิบัติการจะใช้ RN, RSK, DP, ELISA ฝูงถือว่าไม่เอื้ออำนวยต่อการติดเชื้อไวรัสรีโอไวรัส โดยที่ระดับแอนติบอดีใน pH เกินกว่าการเจือจางที่ 1:40
โรคข้ออักเสบจากไวรัสต้องแยกความแตกต่างจากโรคหลอดลมอักเสบติดเชื้อ, EDS-76 และโรคมัยโคพลาสโมซิสทางเดินหายใจ ด้วยโรคเหล่านี้ทำให้เส้นเอ็นไม่หนาขึ้น
การรักษาและการป้องกัน
หนึ่งในเงื่อนไขหลักในการต่อสู้กับการติดเชื้อ reovirus ของนกคือการป้องกันไม่ให้เกิดการติดเชื้อจากฟาร์มที่ไม่เอื้ออำนวยต่อโรคนี้ การวางไข่ควรดำเนินการหลังจากการฆ่าเชื้อแบบเปียกเท่านั้น หลังจากการฆ่าเชื้อแบบเปียก ไข่จะถูกทำให้แห้งและฟักในตู้ฟักที่เตรียมไว้อย่างระมัดระวัง
 |
|
| โรคข้ออักเสบจากไวรัส: ความเสียหายของตับ |
หากสงสัยว่าติดเชื้อ reovirus เพื่อเพิ่มความต้านทานโดยรวม อาหารจะได้รับการปรับปรุงสำหรับปศุสัตว์ทั้งหมด โดยให้วิตามินในปริมาณที่ต่อต้านความเครียด อุณหภูมิมาตรฐานในห้องเพิ่มขึ้น 2-3 องศา ปรับปรุงการแลกเปลี่ยนอากาศ มีการใช้ยาปฏิชีวนะในวงกว้างในอาหารเป็นเวลา 3-4 วัน สิ่งสำคัญคือต้องสร้างสถานะสารต้านอนุมูลอิสระที่สูงในร่างกายของนก เนื่องจากมีส่วนช่วยให้ร่างกายต้านทานต่อไวรัสซ้ำและการพัฒนาของการติดเชื้อ เพื่อจุดประสงค์นี้ ขอแนะนำให้ใช้โซเดียมเซเลไนต์ในอาหารในขนาดอย่างน้อย 1 กรัมต่ออาหารตัน วิตามินอี - 20-40 กรัมต่ออาหารตัน เช่นเดียวกับซานโตชิน - 200 กรัม / ตัน เช่นเดียวกับกรดแอสคอร์บิก - 50 กรัม / ตัน
ในฝูงที่ผิดปกติ การรักษาจะดำเนินการตามข้อบ่งชี้เพื่อไม่ให้เกิดการติดเชื้อที่ซับซ้อน และเพิ่มความต้านทานของนก ในห้องที่มีการแยกนกป่วยออก การฆ่าเชื้อด้วยละอองลอยจะดำเนินการด้วยสารละลายไตรเอทิลีนไกลคอลตามคำแนะนำในปัจจุบัน
สำหรับการป้องกันการติดเชื้อนี้โดยเฉพาะ จะใช้วัคซีนที่มีชีวิตและวัคซีนเชื้อตาย
การติดเชื้อ Reovirus ในนก (tenosynovitis, โรคข้ออักเสบจากไวรัส, ขาอ่อนแรง, reoviral proventriculitis, "การดูดซึมไม่ดี", "นกสีซีด", "cloacae ติดกาว", pullet monocytosis ฯลฯ ) ได้รับการจดทะเบียนในทุกประเทศทั่วโลกและมี กระแสน้ำกึ่งเฉียบพลัน เรื้อรัง หรือแฝงอยู่ แพร่หลายในไก่ ไก่งวง ห่าน และนกซินแอนโทรปิก
Tenosynovitis เป็นโรคติดต่อที่เกิดจากไวรัสรีโอไวรัส โดยมีลักษณะเฉพาะคืออาการขาเจ็บที่เกี่ยวข้องกับการอักเสบของกล้ามเนื้อดิจิตัลเฟลกเซอร์ เอ็นกล้ามเนื้อยืดกล้ามเนื้อทาร์ซัล และเบอร์ซา ในหลักสูตรเรื้อรังจะมาพร้อมกับการแตกของเอ็นและการพังทลายของกระดูกอ่อนข้อ
ไวรัสนี้ถูกแยกได้ครั้งแรกในสหรัฐอเมริกาในปี พ.ศ. 2511 ในไก่เนื้อ และในปี พ.ศ. 2517 และ พ.ศ. 2518 มีการระบุไวรัส avireo ในไก่งวงและห่านในประเทศของเรา แยกสายพันธุ์ Epizootic ของเชื้อโรคจากไก่และไก่งวง ศึกษาคุณสมบัติทางเคมีกายภาพ เสนอวิธี (RDP และ RNHA) ในการวินิจฉัยโรค
อย่างไรก็ตาม เนื่องจากอาการทางคลินิกที่หลากหลายมาก ความซับซ้อนในการตีความการเปลี่ยนแปลงที่สังเกตได้ระหว่างการตรวจชันสูตรพลิกศพ ตลอดจนความยากลำบากในการพิสูจน์บทบาททางสาเหตุของไวรัส avireoviruses โรคเหล่านี้ในนกจึงยังไม่เป็นที่เข้าใจจนถึงปัจจุบัน
สาเหตุของโรคคือ reovirus ที่มี RNA ซึ่งมีเส้นผ่านศูนย์กลางอนุภาค 75-76 นาโนเมตร ทนความร้อนและทนทานต่ออุณหภูมิ 60°C เป็นเวลา 8-10 ชั่วโมง, 56°C นานสูงสุด 22-24 ชั่วโมง, 37°C นานสูงสุด 15-16 สัปดาห์, 22°C นานสูงสุด 48-61 สัปดาห์ , 4°C นานถึง 3 ปี, — 20°C นานกว่า 4 ปี, ทนทานต่ออีเทอร์, คลอโรฟอร์ม, รังสี UV และคงกิจกรรมไว้หลังจากการฆ่าเชื้อด้วยไอฟอร์มาลดีไฮด์ ไวรัสจะถูกยับยั้งด้วยโซเดียมไฮดรอกไซด์ 3% เอทานอล 70% สารประกอบอินทรีย์ไอโอดีน 0.5% เอสสเตอริล 0.1% เป็นเวลา 3 นาทีที่ +20°C และฟอร์มาลิน 3% ที่ +56°C เป็นเวลา 30 นาที
โรคนี้ทำให้นกตายในกรณี 5-30% ลดความสามารถในการฟัก ทำให้ไก่แคระ นำไปสู่การคัดแยกนก 2 ถึง 15% และมีฤทธิ์กดภูมิคุ้มกัน
ปัจจัยโน้มนำของโรค ได้แก่: การละเมิดเทคโนโลยีการเลี้ยงสัตว์ปีก (การบดอัดมากเกินไป อุณหภูมิต่ำกว่าปกติ การปลูกถ่าย) ความเป็นกรดของอาหารที่เพิ่มขึ้น การให้อาหารที่ไม่สมดุลในแง่ของโปรตีน คาร์โบไฮเดรต วิตามิน มาโคร และองค์ประกอบย่อย
อาการทางคลินิกและการเปลี่ยนแปลงทางพยาธิวิทยาขึ้นอยู่กับความรุนแรงและปริมาณของเชื้อโรค วิธีการใช้ และการต้านทานของนก ระยะฟักตัวใช้เวลา 5 ถึง 13 วัน ในนก 5-10% มีอาการขาเจ็บในระดับที่แตกต่างกันบวมที่ข้อต่อขากของขาข้างหนึ่งหรือทั้งสองข้างการเดินหยิ่งทะนงการบิดนิ้วเนื่องจากการแตกของเอ็น เส้นเอ็นที่ได้รับผลกระทบจะมีความหนาแน่นมากขึ้น แข็งขึ้น คลายตัว และเกาะติดกับผิวหนัง
ในไก่เนื้อ นกมากถึง 30% แคระแกรน 5-18% ตาย เมื่ออายุ 3 สัปดาห์ นกจะแคระแกร็น ขนไม่ดี และท้องร่วง เมื่อเปิดไก่เนื้อที่ตายแล้วจะสังเกตเห็นโรคหวัดลำไส้อักเสบ, ไตขยายใหญ่, โรคถุงอัณฑะอักเสบ, กระเพาะอาหารของกล้ามเนื้อบางลง
สำหรับนกที่โตเต็มวัย โรคนี้มีลักษณะเรื้อรังหรือแฝงอยู่ถาวรมากกว่า ในกรณีนี้การผลิตไข่ลดลง นก 20-30% หมดลง 5-10% ของบุคคลถูกคัดออก นก 1-2% ตาย ในการชันสูตรพลิกศพจะมีการบันทึกอาการบวมน้ำของปลอกเอ็น, การหนาและการแตกของเอ็น, ข้อต่อ ankylosis, ลำไส้อักเสบจากหวัด, การเพิ่มขึ้นอย่างรวดเร็วในไต, ภาวะเลือดคั่งของตับอ่อนและความอ่อนแอของกล้ามเนื้อหัวใจ
การวิเคราะห์สถานการณ์การแพร่ระบาดของไวรัส teposipovit ในไก่ในสหพันธรัฐรัสเซียในช่วงทศวรรษที่ผ่านมา บ่งชี้ถึงการแพร่กระจายของโรคในวงกว้าง ด้วยวิธีการของ ELISA, MFA, การศึกษาทางไวรัสวิทยาและพยาธิสัณฐานวิทยา การคงอยู่ของเชื้อโรคเกิดขึ้นใน 90-95% ของฟาร์มสัตว์ปีกที่ทำการสำรวจ โดยเชี่ยวชาญด้าน Loman Brown Cross และสัตว์ปีกเนื้อ มีการเปิดเผยการก่อโรคที่หลากหลายของไวรัสที่แยกได้ซึ่งหมุนเวียนในประเทศ
ในกระบวนการศึกษาโรคนี้ นักวิทยาศาสตร์ของ VNIVIP ได้สร้างลักษณะทางระบาดวิทยาในไก่ ตัวอย่างเช่น เห็นได้ชัดว่าแหล่งที่มาของการติดเชื้อคือนกป่วยและตาย พาหะไวรัสแฝง ไข่ฟักและของเสียจากการฟัก อาหารที่ปนเปื้อนเชื้อโรค อุปกรณ์เทคโนโลยีที่ติดเชื้อ การแพร่เชื้อไวรัสเกิดขึ้นโดยการสัมผัส ทางอากาศ หรือทางอาหาร เชื้อโรคมีลักษณะการติดต่อสูงยังคงอยู่ในร่างกายของนก ไก่ที่อ่อนแอต่อโรคมากที่สุดคือไก่อายุตั้งแต่ 1 ถึง 6 วัน ปัจจัยความเครียดมีความสำคัญ
Tenosynovitis Reoviral มักเกิดขึ้นร่วมกับโรคแบคทีเรียหรือไวรัสอื่นๆ
นักวิทยาศาสตร์ของ VNIVIP ได้พัฒนาและแนะนำแนวทางปฏิบัติของการเลี้ยงสัตว์ปีกเชิงอุตสาหกรรม โดยใช้ชุดวินิจฉัยอิมมูโนเอ็นไซม์สำหรับโรคทีโนซิโนอักเสบจากไวรัสในไก่ เพื่อตรวจหาแอนติบอดีจำเพาะในเลือดของนก และประเมินภูมิคุ้มกันหลังการฉีดวัคซีนเพื่อป้องกันโรคนี้ Diagnosticum มีความไวและความจำเพาะสูง ติดตั้งง่าย ช่วยให้กระบวนการวิจัยเป็นไปโดยอัตโนมัติ ไม่ด้อยกว่าระบบทดสอบที่ดีที่สุดของบริษัทต่างประเทศ
ผู้เชี่ยวชาญของสถาบันโดยวิธีการผ่านตัวอ่อนไก่และการเพาะเลี้ยงเซลล์เป็นระยะ ๆ ได้ลดความเครียด "VNI-VIP-DEP" ซึ่งตามเครื่องหมายทางพันธุกรรมหลักนั้นสอดคล้องกับสายพันธุ์อ้างอิงของไวรัสรีโอไวรัสในนก เทคโนโลยีในการผลิตวัคซีนป้องกันไวรัส "TENOVAC" ได้รับการพัฒนาและเชี่ยวชาญบนพื้นฐานของสายพันธุ์ วัคซีนนี้เหมาะสำหรับการผลิตจำนวนมากและใช้ในการเลี้ยงสัตว์ปีกเพื่อป้องกันการติดเชื้อรีโอซิโนอักเสบจากไวรัสในไก่โดยเฉพาะ โดยได้รับสิทธิบัตรการประดิษฐ์และใบรับรองเครื่องหมายการค้าแล้ว โครงการได้รับการพัฒนาสำหรับการใช้วัคซีนเพื่อวัตถุประสงค์ในการป้องกัน - การฟื้นฟูฟาร์มจากโรคนี้ ตั้งแต่ปี 1997 ถึง 2000 มีการผลิตวัคซีนนำร่อง 10 ชุดจำนวน 20 ล้านโดสซึ่งใช้ในฟาร์มสัตว์ปีก: Glazovskaya, Varaksinskaya, Botkinskaya, Uvinskaya (Udmurtia), Okinskaya (ภูมิภาค Irkutsk) .), "Zaozerskaya ", "Lebedevskaya" (ภูมิภาคโนโวซีบีร์สค์), ดินแดนครัสโนดาร์และครัสโนยาสค์ และภูมิภาครอสตอฟ
พนักงานของภาควิชาไวรัสวิทยาและโรคเนื้องอกของนก VNIVIP ประกอบด้วยนักวิชาการของ Russian Academy of Agricultural Sciences Korovin R.N., Doctor of Veterinary Sciences Trefilov B.B., Candidates of Spider Nikitina N.V. และ Yavdoshak L.M. ได้รับประกาศนียบัตรจาก Presidium of Russian Academy of Agricultural Sciences "เพื่อการพัฒนาทางวิทยาศาสตร์ที่เสร็จสมบูรณ์ดีที่สุดแห่งปี
อาลีฟ เอ.เอส. ศาสตราจารย์ ดร.สัตวแพทย์. วิทยาศาสตร์
สถาบันสัตวแพทยศาสตร์แห่งรัฐเซนต์ปีเตอร์สเบิร์ก
Alieva A.K. ผู้ช่วยปริญญาเอก ไบโอล วิทยาศาสตร์
มหาวิทยาลัยการสอนแห่งรัฐรัสเซีย ก.และ. เฮอร์เซน
สรุป: บทความนี้ตระหนักถึงการทบทวนไวรัส ซึ่งมักทำให้เกิดการแตกหักของกระเพาะและลำไส้อักเสบในฝูงสัตว์ปีกเชิงพาณิชย์ ความรู้ดังกล่าวจำเป็นต่อการวินิจฉัยโรคระบบทางเดินอาหาร ซึ่งอาจสร้างความเสียหายร้ายแรงต่อเศรษฐกิจของอุตสาหกรรมได้
คำอธิบายประกอบ: บทความนี้เป็นภาพรวมของไวรัสที่ทำให้เกิดการระบาดของโรคกระเพาะและลำไส้อักเสบในสัตว์ปีกอุตสาหกรรมโดยทั่วไป ความรู้นี้จำเป็นสำหรับการวินิจฉัยโรคระบบทางเดินอาหารซึ่งก่อให้เกิดความเสียหายทางเศรษฐกิจอย่างร้ายแรงต่ออุตสาหกรรมสัตว์ปีก
คำสำคัญ: ไก่ ไก่งวง โรคระบบทางเดินอาหาร การติดเชื้อ การวินิจฉัย ไวรัส การเกิดโรค
โรคระบบทางเดินอาหารที่เกิดจากเชื้อไวรัสพบได้ในไก่และไก่งวงทุกช่วงอายุ แต่สัตว์เล็กมักป่วยเป็นส่วนใหญ่ อาการทางคลินิกของการติดเชื้อเหล่านี้แตกต่างกันอย่างมาก ตั้งแต่สัญญาณที่ไม่ปรากฏซึ่งสร้างความเสียหายทางเศรษฐกิจเพียงเล็กน้อย ไปจนถึงรูปแบบที่รุนแรงซึ่งส่งผลให้เกิดการสูญเสียทางเศรษฐกิจครั้งใหญ่ ผลลัพธ์ของโรคติดเชื้อเหล่านี้ขึ้นอยู่กับปัจจัยต่างๆ ที่สัมพันธ์กัน เช่น ความรุนแรงของเชื้อโรค อายุและการต้านทานของนกที่ติดเชื้อ ภายใต้สภาวะทางธรรมชาติ การติดเชื้อเหล่านี้มักมีความซับซ้อนจากเชื้อโรคอื่นๆ นอกจากนี้หลักสูตรของพวกเขายังขึ้นอยู่กับเงื่อนไขการควบคุมตัว การให้อาหาร และปัจจัยด้านสิ่งแวดล้อมต่างๆ ภายใต้เงื่อนไขการผลิต ค่อนข้างยากที่จะประเมินบทบาททางสาเหตุของสารเหล่านี้ในการเกิดโรคของการเกิดโรคเฉพาะในนก
เพื่อพัฒนาวิธีการวินิจฉัยโรคสัตว์ปีกที่ทำให้เกิดความผิดปกติของระบบทางเดินอาหารจำเป็นต้องมีความรู้ทางชีววิทยาของไวรัสการเกิดโรคและลักษณะทางระบาดวิทยาของอาการ
ปัจจุบันมีการใช้กล้องจุลทรรศน์อิเล็กตรอน (EM) เพื่อระบุไวรัสหลายชนิดที่เกี่ยวข้องกับโรคระบบทางเดินอาหารในสัตว์ปีก อย่างไรก็ตาม การจำแนกลักษณะโดยละเอียดของไวรัสที่แยกได้และการประเมินบทบาทในการพัฒนาของการติดเชื้อเป็นปัญหาร้ายแรง เนื่องจากส่วนสำคัญของไวรัสนั้นยากและบางครั้งก็เป็นไปไม่ได้ที่จะเพาะเลี้ยงในหลอดทดลอง เช่นเดียวกับการแพร่พันธุ์ไม่ใช่เรื่องง่าย โรคที่เกิดขึ้นภายใต้เงื่อนไขการทดลอง ความคืบหน้าเพิ่มเติมในการศึกษาคุณสมบัติของไวรัส enteropathogenic และบทบาทของพวกเขาในสาเหตุของโรคระบบทางเดินอาหารในสัตว์ปีกจะเกี่ยวข้องกับการพัฒนาเทคนิคสำหรับการเพาะปลูกในหลอดทดลองอย่างไม่ต้องสงสัยการใช้วิธีการวินิจฉัยที่ทันสมัยโดยเฉพาะการใช้โมโนโคลนอลแอนติบอดีและ ปฏิกิริยาลูกโซ่โพลีเมอเรส (PCR)
โรคกระเพาะและลำไส้อักเสบจากไวรัสเป็นที่แพร่หลายในหลายประเทศทั่วโลกด้วยการเลี้ยงสัตว์ปีกที่ได้รับการพัฒนาโดยเฉพาะในฟาร์มประเภทอุตสาหกรรมซึ่งสร้างความเสียหายทางเศรษฐกิจอย่างมีนัยสำคัญที่เกี่ยวข้องกับการจากไปของสัตว์ปีก ตัวชี้วัดการผลิตลดลงเนื่องจากน้ำหนักที่เพิ่มขึ้นในแต่ละวันลดลงเนื่องจากการสูญเสีย ความอยากอาหารและการเพิ่มขึ้นของความหลากหลายของฝูง
รอยโรคที่เกิดจากไวรัสที่เยื่อเมือกในลำไส้ ประการแรก ทำหน้าที่เป็นช่องทางสำหรับการแทรกซึมของเชื้อโรคที่อาจเกิดขึ้นอื่นๆ เช่น Escherichia coli และ Salmonella spp. เป็นต้น) รอยโรคที่เยื่อเมือกทำให้การดูดซึมและการสลายตัวของมอลโตสลดลง ซึ่งนำไปสู่การขาดวิตามินและแร่ธาตุที่ละลายในไขมันในร่างกายของนก การทดลองการติดเชื้อในไก่เนื้อด้วยไวรัสที่ก่อโรคทำให้เกิดโรคกระดูกอ่อน โรคกระดูกพรุน และความเสียหายต่อโครงกระดูกอื่นๆ ความผิดปกติของระบบเมตาบอลิซึมในร่างกายที่เกี่ยวข้องกับไวรัสเหล่านี้ส่งผลให้อัตราการเจริญเติบโตของไก่ลดลง การฝ่อของถุง Fabricius และต่อมไทมัส ซึ่งจะทำให้เกิดการขาดอิมมูโนโกลบูลินและเพิ่มความไวต่อเชื้อโรคของโรคติดเชื้ออื่น ๆ ไวรัสนกบางชนิดก่อให้เกิดอันตรายต่อมนุษย์ นอกจากนี้ ยังมีการระบุไวรัสหลายชนิดที่มีบทบาทด้านสาเหตุที่ไม่ชัดเจนในสัตว์ปีกด้วยกล้องจุลทรรศน์อิเล็กตรอนของอุจจาระและลำไส้
การติดเชื้อ Enteroviral ของนกที่ส่งผลต่อระบบทางเดินอาหารเป็นแบบ polyetiological ปัจจุบันทราบว่ามีไวรัสอย่างน้อย 10 กลุ่มที่เกี่ยวข้องกับการเกิดความผิดปกติของลำไส้เฉียบพลันในนก สิ่งเหล่านี้รวมถึง rota-, pararotaviruses-, Corona-, entero-, adeno-, rheo-, astro-caliciviruses-, pestiviruses- และ parvoviruses ซึ่งเมื่อความต้านทานโดยรวมของสิ่งมีชีวิตลดลงอาจทำให้เกิดการสูญเสียทางเศรษฐกิจอย่างมีนัยสำคัญเนื่องจาก การสะสมของโรคอื่น ๆ การละเมิดเงื่อนไขการควบคุมตัวและอิทธิพลของปัจจัยด้านสิ่งแวดล้อมที่ไม่เอื้ออำนวย
การทบทวนนี้ให้ข้อมูลเกี่ยวกับโรตาไวรัส โคโรโนไวรัส อดีโนไวรัส รีโอไวรัส แอสโตรไวรัส และพาร์โวไวรัส ซึ่งส่วนใหญ่มักทำให้เกิดการระบาดของโรคกระเพาะและลำไส้อักเสบในสัตว์ปีก
โรตาไวรัส
โรตาไวรัสทำให้เกิดอาการลำไส้อักเสบในนกและสัตว์เลี้ยงลูกด้วยนมหลายชนิด รวมถึงมนุษย์ด้วย เป็นครั้งแรกที่ Bergeland et. ตรวจพบการติดเชื้อโรตาไวรัสพร้อมอาการลำไส้อักเสบและของเสียที่เพิ่มขึ้น อัล ในปีพ.ศ. 2520 ในสัตว์ปีกไก่งวง ต่อมาตรวจพบไวรัสโรตาในไก่ ไก่ฟ้า เป็ด และในนกป่าด้วย
โรตาไวรัสอยู่ในวงศ์ Reoviridae และมีลักษณะเป็นทรงกลม มีเส้นผ่านศูนย์กลางประมาณ 70 นาโนเมตร ชื่อของไวรัสมาจากคำภาษาละตินว่า "rota" ซึ่งเป็นวงล้อที่บอกลักษณะทางสัณฐานวิทยาของ virions ในรูปของเฟืองล้อ สัณฐานวิทยาของโรตาไวรัสที่แยกได้จากสัตว์เลี้ยงลูกด้วยนมและนกจะเหมือนกัน อนุภาคไวรัสที่สมบูรณ์ประกอบด้วยแคปโซเมอร์สองชั้นหรือชั้นเดียว มีเพียงไวรัสที่มี double capsid เท่านั้นที่มีฤทธิ์ในการติดเชื้อ โดยมีความยาวถึง 70–75 นาโนเมตร
จีโนมของไวรัสประกอบด้วย RNA แบบเกลียวคู่ซึ่งมี 11 ส่วนโดยมีน้ำหนักโมเลกุลรวม 12–20 MDa แต่ละส่วน RNA มีกรอบการอ่านแบบเปิดที่เข้ารหัสสำหรับโปรตีนเดี่ยว การจำลองแบบและการประกอบของโรตาไวรัสเกิดขึ้นในไซโตพลาสซึม ดังนั้นอนุภาคโรตาไวรัสจึงมักพบในแวคิวโอล โรตาไวรัสทนต่ออีเทอร์ ค่า pH ต่ำ (3.0) และค่อนข้างทนต่อความร้อน
โรตาไวรัสในสัตว์ปีกถูกจำแนกประเภทโดยปฏิกิริยาข้ามอิมมูโนฟลูออเรสเซนซ์และโดยอิเล็กโตรโฟเรซิสโพลีอะคริลาไมด์เจล (PAG) ของจีโนม RNA โรตาไวรัสที่ทำปฏิกิริยาใน MFA ด้วยซีรั่มเฉพาะต่อโรตาไวรัสกลุ่ม A ของสัตว์เลี้ยงลูกด้วยนมจัดอยู่ในประเภทโรตาไวรัสกลุ่ม A โรตาไวรัสที่มีปฏิกิริยาข้ามที่อ่อนแอกับแอนติเจนโรตาไวรัสกลุ่ม A ของสัตว์เลี้ยงลูกด้วยนมจัดอยู่ในประเภทผิดปรกติ ในทางกลับกัน มีกลุ่มที่แตกต่างกันทางแอนติเจนสามกลุ่ม กลุ่มหนึ่งจัดเป็นกลุ่ม D ส่วนอีกสองกลุ่มไม่จัดประเภท
โรตาไวรัสกลุ่ม D พบได้ในนกเท่านั้น การวิเคราะห์ด้วยไฟฟ้าใน PAG ซึ่งขึ้นอยู่กับความแตกต่างในการย้ายถิ่นระหว่างส่วนต่างๆ ของจีโนมโรตาไวรัส เป็นเครื่องมือสำคัญในการจำแนกประเภท และถูกนำมาใช้อย่างประสบความสำเร็จในการประเมินเบื้องต้นของสายพันธุ์ epizootic ข้อดีของวิธีนี้คือใช้มูลหรือสิ่งที่อยู่ในลำไส้ของนกที่ป่วย โดยไม่ต้องแยกและเพาะเลี้ยงไวรัสก่อน
การติดเชื้อโรตาไวรัสเกิดขึ้นทางเดินอาหาร แหล่งที่มาของไวรัสคือนกที่ป่วยและหายดีแล้ว ซึ่งมีเชื้อโรคอยู่ในครอกมากที่สุด Rotaviruses ทวีคูณใน villi ที่แตกต่างกันของเซลล์เยื่อบุผิวของลำไส้เล็กการขับถ่ายสูงสุดของไวรัสพร้อมอุจจาระจะสังเกตได้ 2-5 วันหลังการติดเชื้อ ที่ด้านบนสุดของ villi มีการโยกย้ายแบบเร่งและการทำลายล้างของ enterocytes ก่อนวัยอันควร (41) ซึ่งถูกแทนที่ด้วยเซลล์เยื่อบุผิวที่ยังไม่บรรลุนิติภาวะและฝังศพใต้ถุนโบสถ์ซึ่งเป็นสาเหตุของกระบวนการย่อยอาหาร เซลล์ที่ยังไม่สมบูรณ์และไม่แตกต่างซึ่งมาแทนที่เซลล์ที่ถูกทำลายโดยไวรัสจะนำไปสู่การขาดมอลโตส ส่งผลให้ความสามารถในการดูดซับลดลง Yason และ Schat ทดลองสาธิตการลดการดูดซึมมอลโตสระหว่างการติดเชื้อโรตาไวรัสในไก่งวงโดยใช้ D-xylose เพื่อจุดประสงค์นี้
อาการทางคลินิกของการติดเชื้อไวรัสโรตาไวรัสในสัตว์ปีกมีตั้งแต่ไม่แสดงอาการไปจนถึงรุนแรง เมื่อทดลองติดเชื้อ อาการทางคลินิกหลักคือท้องเสีย นอกจากนี้ อาจมีความวิตกกังวลเกี่ยวกับนก การเบียดเสียด น้ำหนักตัวลดลง ภาวะขาดน้ำ และการเสียชีวิตเพิ่มขึ้น ในกรณีที่รุนแรงนกจะตายใน 2-4 วันของเสียจะอยู่ที่ 4 ถึง 7% ในไก่ฟ้าอายุ 6-40 วัน โรคนี้จะแสดงอาการซึมเศร้า ท้องร่วงเป็นน้ำ และมีของเสียเพิ่มขึ้น (20-30%) อาการทางคลินิกของโรคในระหว่างการทดลองติดเชื้อโรตาไวรัสในไก่และไก่งวงจะแตกต่างกันอย่างมาก: จากระดับปานกลางไปจนถึงไม่ปรากฏ ซึ่งสัมพันธ์กับความรุนแรงของไวรัสโรตาไวรัสที่แตกต่างกัน อิทธิพลของการติดเชื้ออื่นๆ อิทธิพลของสิ่งแวดล้อม และสภาวะการเลี้ยงสัตว์ปีก (32)
ระยะเวลาฟักตัวของการติดเชื้อโรตาไวรัสคือ 2-5 วัน ทำให้เกิดอาการท้องร่วงในไก่งวงและลำไส้อักเสบเล็กน้อยในไก่ นักวิทยาศาสตร์บางคนสังเกตเห็นความไวสูงต่อการติดเชื้อในไก่และไก่งวงที่โตเต็มวัยเมื่อเปรียบเทียบกับลูกไก่ (69) โรตาไวรัสทำให้การผลิตไข่ลดลงในแม่ไก่ไข่
ในการชันสูตรศพของนกที่ตายแล้วพบว่าร่างกายขาดน้ำสีซีดของเยื่อเมือกของลำไส้และอาการบวมของลำไส้ใหญ่เนื่องจากการสะสมของของเหลวและก๊าซรวมถึงการอักเสบของฝ่าเท้าของแขนขา
ตรวจพบการเปลี่ยนแปลงทางเนื้อเยื่อในลำไส้เล็กส่วนต้นและลำไส้ใหญ่ เซลล์ทรงกระบอกของ villi จะถูกแทนที่ด้วยเซลล์แบน villi จะสั้นลงพวกมันจะรวมกันและต่อมาเยื่อเมือกจะสูญเสีย villi และกลายเป็นเรียบ
ระบาดวิทยา อาการทางคลินิก และการเปลี่ยนแปลงทางพยาธิสัณฐานวิทยา มีบทบาทสนับสนุนในการวินิจฉัยโรคท้องร่วงจากไวรัสโรตา การมีอยู่ของแอนติบอดีในเลือดของนกก็ไม่สำคัญเช่นกัน เนื่องจากมีการบันทึกไว้ในนกที่โตเต็มวัยส่วนใหญ่ การวินิจฉัยการติดเชื้อโรตาไวรัสมักขึ้นอยู่กับการตรวจหาและจำแนกไวรัสหรือแอนติเจนของไวรัสโดยใช้กล้องจุลทรรศน์อิเล็กตรอน (EM) หรือกล้องจุลทรรศน์อิมมูโนอิเล็กตรอนของตัวอย่างมูลสัตว์ สิ่งที่มีอยู่ในลำไส้ หรือการขูดจากเยื่อเมือกของลำไส้เล็ก วิธีการของแอนติบอดีเรืองแสงถูกนำมาใช้กันอย่างแพร่หลายในการศึกษารอยเปื้อนในอุจจาระ รอยพิมพ์ และส่วนครีโอสแตตของลำไส้เล็ก รวมถึงการเพาะเลี้ยงเซลล์ที่ติดเชื้อ
การตรวจครอกโดยใช้ EM เป็นวิธีการที่ละเอียดอ่อนที่สุดในการตรวจหาไวรัสโรตาไวรัสโดยไม่คำนึงถึงกลุ่มซีโรกรุ๊ป EM ภูมิคุ้มกันและวิธีการของฟลูออเรสเซนต์แอนติบอดี (MFA) ใช้เพื่อระบุซีโรกรุ๊ปของโรตาไวรัส เป็นที่ยอมรับแล้วว่าการตรวจหา rotavirus RNA ในอุจจาระใน PAG นั้นไม่ได้ด้อยกว่าในเรื่องความไวต่อ EM
เนื่องจากความยากลำบากในการปลูกฝังโรตาไวรัสในการเพาะเลี้ยงเซลล์ การแยกเชื้อโรคจึงไม่ได้ดำเนินการเสมอไปในการวินิจฉัยโรค ในปัจจุบัน มีเพียงโรตาไวรัสกลุ่ม A และซีโรกรุ๊ป D สายพันธุ์แต่ละสายพันธุ์เท่านั้นที่ได้รับการเพาะเลี้ยงในการเพาะเลี้ยงเซลล์ โดยมีข้อยกเว้นที่หายาก ในการดำเนินการนี้ ให้ใช้การเพาะเลี้ยงเซลล์ที่ปลูกถ่าย MA-104 หรือการเพาะเลี้ยงเซลล์ปฐมภูมิของเซลล์ตับของตัวอ่อนไก่และไตของไก่ การเติมทริปซิน (1–10 ไมโครกรัม/มิลลิลิตร) ลงในอาหารบำรุงจะเพิ่มการสะสมของโรตาไวรัสในเซลล์ที่ปลูกถ่ายและในการเพาะเลี้ยงไตปฐมภูมิ 100–1,000 เท่า ผู้เขียนเชื่อว่าทริปซินช่วยเพิ่มการซึมผ่านของเยื่อหุ้มเซลล์และช่วยให้ไวรัสเข้าสู่เซลล์ได้ง่ายขึ้น
โรตาไวรัสถูกขับออกมาเป็นขยะในปริมาณมาก และค่อนข้างต้านทานต่อปัจจัยทางกายภาพและเคมีต่างๆ พวกเขายังคงอยู่ในครอกเป็นเวลานาน ปนเปื้อนอุปกรณ์ดูแลตลอดจนอาณาเขตของฟาร์มสัตว์ปีก นอกจากนี้ ไม่รวมการแพร่กระจายของเชื้อโรคผ่านรังไข่ ดังที่เห็นได้จากการตรวจจับโรตาไวรัสในไก่อายุหนึ่งวัน เป็นไปได้ที่โรตาไวรัสจะยังคงอยู่ในเปลือกไข่หรือในไข่ และหลังจากการฟักเป็นตัวเป็นก้อนของลูกอ่อน มันก็จะติดเชื้อซ้ำอีก ยังไม่มีการศึกษาพาหะของไวรัสในสัตว์ปีกตลอดจนพาหะของการแพร่กระจายของเชื้อโรค
ยังไม่มีการพัฒนาวิธีการรักษาและการป้องกันการติดเชื้อโรตาไวรัสโดยเฉพาะ การแพร่หลายของโรตาไวรัสและความคงอยู่ของพวกมันเป็นอุปสรรคต่อสวัสดิภาพของธุรกิจสัตว์ปีกที่ยั่งยืน การป้องกันโรคนี้ลดลงเหลือแค่การเปลี่ยนขยะในโรงเรือนสัตว์ปีกที่ผิดปกติและการฆ่าเชื้อในสถานที่อย่างทันท่วงที ซึ่งช่วยลดระดับการปนเปื้อนในสิ่งแวดล้อมและความเสี่ยงต่อการติดเชื้อในนก หากเกิดโรคและท้องเสีย การแพร่กระจายของการติดเชื้อจะอำนวยความสะดวกด้วยการนอนไม่เพียงพอ มาตรการในการปรับปรุงระบบระบายอากาศ ปรับอุณหภูมิให้เหมาะสม และเพิ่มผ้าปูที่นอนใหม่ ช่วยลดการแพร่กระจายของการติดเชื้อโรตาไวรัส และการแสดงผลกระทบด้านลบ
CORONAVIRUS ENTERITIS ของตุรกี
โรคลำไส้อักเสบจากเชื้อไวรัสโคโรนาในตุรกีเป็นโรคร้ายแรงที่ส่งผลต่อไก่งวงทุกวัย ไก่ ไก่ฟ้า นกกระทามีภูมิคุ้มกันต่อสาเหตุของการติดเชื้อนี้ โรคลำไส้อักเสบจากเชื้อไวรัสโคโรนาจดทะเบียนในสหรัฐอเมริกา แคนาดา ออสเตรีย และอินเดีย ในการปลูกไก่งวงตลอดทั้งปี สาเหตุที่พบบ่อยที่สุดของโรคกระเพาะและลำไส้อักเสบ (คิดเป็นประมาณ 50% ของทุกกรณีของโรคท้องร่วง) คือโคโรนาไวรัส และเป็นเรื่องยากมากที่จะปรับปรุงฟาร์มดังกล่าว
สาเหตุของโรคคือไวรัสที่มี RNA ของตระกูล Coronaviridae ไวรัสในตระกูลนี้มีลักษณะทางสัณฐานวิทยา: พวกมันเป็นแบบ polymorphic, ห่อหุ้ม, เส้นผ่านศูนย์กลางของ virions อยู่ที่ 60 ถึง 220 นาโนเมตร, ความยาว 12–24 นาโนเมตร, พื้นผิวของ virions เป็นรูปกลีบดอก โคโรนาไวรัสประกอบด้วยโปรตีนโครงสร้างหลักอย่างน้อยสามชนิด รวมถึงไกลโคโปรตีนขนาดใหญ่ในรูปแบบของส่วนที่ยื่นออกมาบนพื้นผิวของไวรัส (เพปโลเมอร์) (S), ไกลโคโปรตีนชนิดซองจดหมายขนาดเล็ก (M) และโปรตีนนิวคลีโอแคปซิด (N)
การจำลองแบบของไวรัสโคโรนาเกิดขึ้นเฉพาะในไซโตพลาสซึม โคโรนาไวรัสเพาะเลี้ยงในเอ็มบริโอไก่หรือไก่งวงโดยการฉีดไวรัสเข้าไปในโพรงน้ำคร่ำ จนถึงขณะนี้ มีเพียงเชื้อไวรัสโคโรนาในควิเบกเท่านั้นที่ได้รับการปรับเปลี่ยนและเพาะเลี้ยงในเซลล์มะเร็งของต่อมในมนุษย์ (HRT) ได้สำเร็จ การจำลองแบบของไวรัสขึ้นอยู่กับการรวมทริปซินเข้ากับการควบคุมค่า pH ปานกลางและเข้มงวด
การศึกษาในกล้องจุลทรรศน์อิเล็กตรอนแบบภูมิคุ้มกัน ปฏิกิริยาการยับยั้งการสร้างเม็ดเลือดแดงแตก และปฏิกิริยาการทำให้เป็นกลาง ได้สร้างความแตกต่างทางแอนติเจนระหว่างไวรัสโคโรนาสายพันธุ์ใหม่กับไวรัสหลอดลมอักเสบจากการติดเชื้อในไก่ อย่างไรก็ตาม ปฏิกิริยาข้ามอิมมูโนฟลูออเรสเซนซ์เผยให้เห็นความสัมพันธ์ของแอนติเจนระหว่างเชื้อโรคเหล่านี้กับความแตกต่างจากโคโรนาไวรัสของสัตว์เลี้ยงลูกด้วยนม โคโรโนไวรัสไก่งวงทุกสายพันธุ์อยู่ในซีโรไทป์เดียวกัน
การติดเชื้อทดลองเป็นไปได้ด้วยการบริหารวัสดุไวรัสในช่องปากและในช่องท้อง การนำถุง Fabricius ที่เป็นเนื้อเดียวกันของนกป่วยมาผสมกับไก่งวงโตเต็มวัยทำให้เกิดโรคเฉียบพลัน ระยะฟักตัวคือ 1-3 วัน โรคนี้แสดงออกโดยภาวะซึมเศร้า ท้องร่วงเป็นน้ำ น้ำหนักลด และภาวะขาดน้ำ ในสัตว์ปีกไก่งวงและไก่งวงทดแทน โรคนี้จะปรากฏขึ้นอย่างกะทันหัน ผิวหนังในบริเวณศีรษะและส่วนอื่น ๆ ที่มองเห็นได้ของร่างกายจะมืดลงและศีรษะจะถอยกลับ เมื่อโรคดำเนินไป ส่วนสำคัญของครอกคือเกลือยูเรต อุบัติการณ์มักจะถึง 100% ของเสียมีตั้งแต่ 5 ถึง 50% รอยโรคมักพบในลำไส้เล็กซึ่งเต็มไปด้วยน้ำและเป็นก๊าซ
ไวรัสจะถูกขับออกทางอุจจาระเป็นเวลาหลายเดือน และแพร่เชื้อทางอุจจาระ-ช่องปาก ดังนั้นผู้สูงอายุอาจเป็นแหล่งที่มาของการติดเชื้อและทำให้สัตว์เล็กติดเชื้อได้ การแพร่กระจายของไวรัสสามารถทำได้โดยกลไก - ผ่านเจ้าหน้าที่บริการ อุปกรณ์ดูแล การขนส่ง รวมถึงนกที่บินอย่างอิสระ ในสภาพแวดล้อมภายนอก ไวรัสสามารถคงอยู่ได้นานหลายปี ยังไม่มีการสร้างการแพร่เชื้อผ่านรังไข่ของเชื้อโรคและพาหะนำการแพร่เชื้อของไวรัส
การวินิจฉัยตามอาการทางคลินิกหรือรอยโรคทางพยาธิวิทยาเพียงอย่างเดียวเป็นเรื่องยาก การวินิจฉัยทางห้องปฏิบัติการขึ้นอยู่กับการแยกไวรัสในเอ็มบริโอไก่และไก่งวง การตรวจหาด้วยกล้องจุลทรรศน์อิเล็กตรอน MFA หรือใช้การศึกษาทางซีรั่มวิทยา
เพื่อแยกไวรัส วัสดุที่มีไวรัสจะถูกนำเข้าไปในโพรงน้ำคร่ำของเอ็มบริโอหลังจากการฟักตัว 6-7 วัน ตามด้วยการตรวจหาไวรัสในการเตรียมจากลำไส้เล็กของเอ็มบริโอใน MFA MFA สามารถใช้ตรวจหาแอนติเจนของไวรัสในเยื่อบุผิวของลำไส้เล็กและเบอร์ซาของไก่งวงที่เป็นโรค เมื่อทำกล้องจุลทรรศน์อิเล็กตรอน ผลบวกลวงอาจเกิดขึ้นได้เนื่องจากมีอยู่ในตัวอย่างที่ศึกษาของชิ้นส่วนของเยื่อหุ้มเซลล์ที่มีลักษณะคล้ายไวรัสโคโรนา
วิธีการตรวจหาเชื้อโรคที่แนะนำคือ EM ภูมิคุ้มกันโดยใช้ซีรั่มภูมิคุ้มกันจำเพาะ เพื่อระบุไวรัส จะมีการตรวจสอบส่วนความเย็นของลำไส้ของตัวอ่อนไก่งวงที่ติดเชื้อด้วยการทดสอบอิมมูโนฟลูออเรสเซนต์ทางอ้อม
เพื่อปรับปรุงฟาร์มที่ไม่เอื้ออำนวยต่อการติดเชื้อโคโรนาไวรัส หลังจากผ่านเงื่อนไขการฆ่าแล้ว นกที่ป่วยจะถูกส่งมอบเป็นเนื้อสัตว์ ตามด้วยการทำความสะอาดและฆ่าเชื้อในสถานที่ การสุขาภิบาลสถานที่เป็นระยะเวลา 3-4 สัปดาห์จะมีประสิทธิภาพสูงในการป้องกันโรค
เอนเทอโรไวรัส
ในช่วงไม่กี่ปีที่ผ่านมา พบว่าไวรัสที่มีลักษณะคล้ายเอนเทอโรไวรัสบางชนิดทำให้เกิดโรคกระเพาะและลำไส้อักเสบในไก่และไก่งวง สารเหล่านี้จัดอยู่ในประเภทสารคล้ายไวรัสเอนเทอโรไวรัส (EPV) เนื่องจากไม่ได้ระบุอย่างชัดเจน ขึ้นอยู่กับขนาดของอนุภาคไวรัส สัณฐานวิทยา การเกิดสัณฐานวิทยา และการตรวจพบในขยะ พวกมันถูกจัดประเภทเป็นเอนเทอโรไวรัส อย่างไรก็ตาม จำเป็นต้องมีการศึกษาทางชีววิทยาและกายภาพ-เคมีเพิ่มเติมของเชื้อโรคเพื่อการจำแนกประเภทที่ถูกต้อง
ไวรัสเอนเทอโรไวรัสในนกแพร่หลายไปทั่วโลก พบได้ในไก่และไก่งวงในไอร์แลนด์เหนือ สหรัฐอเมริกา ฝรั่งเศส และมาเลเซีย
Enteroviruses เป็นสมาชิกหนึ่งในเก้าจำพวกที่ประกอบเป็นตระกูล Picornaviridae Picornaviruses ไม่ได้ถูกห่อหุ้ม แต่มีรูปร่างแบบ icosahedral เส้นผ่านศูนย์กลางของอนุภาคไวรัสอยู่ที่ 22–30 นาโนเมตร Virions ไม่มีคุณลักษณะเฉพาะ แต่มี RNA ขั้วบวกแบบเกลียวเดี่ยวซึ่งติดเชื้อได้
สกุลของวงศ์ Picornaviridae แบ่งตามความไวของเอนเทอโรไวรัสต่อกรด ความหนาแน่นของไวรัสในซีเซียมคลอไรด์ และลักษณะทางคลินิกของนกที่ติดเชื้อ Enteroviruses สามารถต้านทานได้ที่ pH 3 เช่นเดียวกับอีเทอร์คลอโรฟอร์มและแอลกอฮอล์ซึ่งบ่งชี้ว่าไม่มีไขมันอยู่ ไม่มีข้อมูลเกี่ยวกับความไวต่อสารฆ่าเชื้อในวรรณกรรม
เชื้อเอนเทอโรไวรัสเพาะเลี้ยงในเอ็มบริโอไก่อายุ 6 วัน โดยประมาณ 50% ของเอ็มบริโอจะตายภายใน 3-7 วัน เอนเทอโรไวรัสบางสายพันธุ์สามารถแพร่พันธุ์บนเยื่อหุ้มคอรีออน-อัลลานโตอิกของเอ็มบริโอ (CAM) สำหรับการเพาะเลี้ยงสายพันธุ์ FP3 และ 612 จะใช้การเพาะเลี้ยงตับไก่และเซลล์ไตเบื้องต้น การมีอยู่ของไวรัสในการเพาะเลี้ยงเซลล์นั้นพิจารณาจาก MFA เนื่องจากผลของไซโตพาติกแสดงออกได้ไม่ดีหรือหายไปเลย
ไวรัสเอนเทอโรไวรัสของตุรกีเพาะเลี้ยงในเอ็มบริโอของไก่งวงอายุ 18 วัน การจำลองแบบของไวรัสเกิดขึ้นในลำไส้ของเอ็มบริโอ ในเอ็มบริโอที่ติดเชื้อ ลำไส้เล็กส่วนต้น เจจูนัม และลำไส้เล็กส่วนต้นจะมีสีซีดและมีอาการบวมน้ำ ตรวจพบไวรัสในส่วนแช่แข็งของลำไส้และในส่วนที่อยู่ภายในโดยใช้กล้องจุลทรรศน์อิเล็กตรอนและ MFA
การจำลองแบบของเอนเทอโรไวรัสเกิดขึ้นในไซโตพลาสซึมของเอนเทอโรไซต์ที่อยู่ระหว่างด้านบนและฐานของวิลลี่ โดยตรวจพบไวรัสที่มีความเข้มข้นสูงสุดใกล้กับห้องใต้ดินโดยตรง โครงสร้างผลึกของไวรัสประกอบด้วยอนุภาคคล้ายไวรัสทรงกลมขนาดเล็กที่มีเส้นผ่านศูนย์กลางประมาณ 23 นาโนเมตร ได้รับการยืนยันจากการทดลองแล้วว่าเอนเทอโรไวรัสของไก่งวงและไก่จะทวีคูณส่วนใหญ่ในเยื่อบุผิวของลำไส้เล็ก ileum และในไต
ภายใต้สภาพธรรมชาตินกจะติดเชื้อเอนเทอโรไวรัสอันเป็นผลมาจากการกินมูลสัตว์ที่ติดเชื้อเข้าไป ไม่มีหลักฐานที่แน่ชัดของการแพร่เชื้อไวรัสผ่านรังไข่ อย่างไรก็ตาม การแยกเอนเทอโรไวรัสออกจากของเสียจากโรงเพาะฟักบ่งชี้ถึงความเป็นไปได้ที่ไวรัสจะแพร่เชื้อผ่านไข่ อย่างน้อยก็ในสายพันธุ์บางสายพันธุ์
การแนะนำเอนเทอโรไวรัสทางปากเข้าไปในโฮสต์ตามธรรมชาติตั้งแต่อายุยังน้อยทำให้เกิดอาการลำไส้อักเสบหรือชะลอการเจริญเติบโต ขึ้นอยู่กับคุณสมบัติทางชีวภาพของไวรัส ในไก่ SPF ที่ติดเชื้อเอนเทอโรไวรัสที่แยกได้ในญี่ปุ่น มีอาการท้องเสียและอัตราการเสียชีวิตสูง (มากถึง 53.3%) ภายใน 6 วันหลังการติดเชื้อ ด้วยความช่วยเหลือของ EM สามารถตรวจพบไวรัสในลำไส้ได้ 1-3 วันหลังการติดเชื้อ เมื่อใช้ครอกจะถูกขับออกภายใน 14 วันหลังการติดเชื้อ อย่างไรก็ตามควรสังเกตว่าตรวจพบเอนเทอโรไวรัสได้แม้ในนกที่มี SPF
ในไก่งวงในวันที่ 4 หลังการติดเชื้อจะมีอาการซึมเศร้ามีมูลเป็นน้ำและในวันที่ 8 ของการทดลองน้ำหนักตัวที่เพิ่มขึ้นจะลดลงอย่างมีนัยสำคัญ ในการชันสูตรพลิกศพพบว่ามีความหนาและการขยายตัวของ caecum เนื่องจากการสะสมของของเหลวฟองสีเหลืองซึ่งมีเมือกหวัดในลำไส้เล็ก ในการชันสูตรพลิกศพ ไก่ที่ติดเชื้อเอนเทอโรไวรัสที่แยกได้ในญี่ปุ่นจะแสดงภาวะไตอักเสบและการสะสมของเกลือยูเรตในอวัยวะภายใน การตรวจทางจุลพยาธิวิทยาเผยให้เห็นความยาวของวิลลี่ในลำไส้เล็กส่วนต้นลดลง และการยืดตัวของห้องใต้ดินในลำไส้เล็กส่วนต้นและลำไส้เล็กส่วนต้น
เพื่อวัตถุประสงค์ในการวินิจฉัย จะมีการตรวจครอกใน EM และ MFA นอกจากนี้ การวินิจฉัยสามารถทำได้โดยการตรวจหาแอนติเจนของไวรัสในเนื้อเยื่อลำไส้หรือในครอกโดยใช้ MFA หรือ ELISA การแยกไวรัสไม่ได้ใช้กันอย่างแพร่หลาย เนื่องจากเอนเทอโรไวรัสส่วนใหญ่ปรับตัวได้ไม่ดีหรือไม่ได้รับการเพาะเลี้ยงในการเพาะเลี้ยงเซลล์และเอ็มบริโอ ตามที่นักวิจัยหลายคนระบุว่างานที่เร่งด่วนที่สุดและในเวลาเดียวกันก็ยากในการศึกษาเอนเทอโรไวรัสคือการกำหนดระดับการมีส่วนร่วมในพยาธิสภาพการติดเชื้อของนก
โรคเลือดออกในตุรกี
โรคริดสีดวงทวารเป็นโรคไวรัสเฉียบพลันในไก่งวงซึ่งกินเวลา 7-10 วัน อาการทางคลินิกของโรคโดยส่วนใหญ่พบในไก่งวงอายุ 4 ถึง 12 สัปดาห์ ระยะฟักตัวนาน 3-6 วัน นกป่วยซึมเศร้า ไม่ยอมกินอาหาร ท้องเสีย มีเศษขยะปนเลือด และเสียชีวิตกะทันหัน ภายใต้สภาพธรรมชาติ อัตราการเสียชีวิตจะอยู่ระหว่าง 1 ถึง 60% และหากติดเชื้อในการทดลองจะสูงถึง 80%
ไวรัสโรคลำไส้อักเสบจากไก่งวง (GEI) ทำให้เกิดความสูญเสียทางเศรษฐกิจอย่างมีนัยสำคัญ มีรายงานโรคนี้ในฟาร์มไก่งวงส่วนใหญ่ โดยเฉพาะในแคนาดา อังกฤษ เยอรมนี ออสเตรเลีย อินเดีย อิสราเอล และญี่ปุ่น จากการศึกษาทางสัณฐานวิทยา มิญชวิทยา ภูมิคุ้มกันวิทยา และการดื้อต่อคลอโรฟอร์ม ไวรัส GEI เช่นเดียวกับไวรัสม้ามลายลายหินอ่อน (MSV) ได้รับมอบหมายให้อยู่ในกลุ่ม II ของวงศ์ Aviadenoviridae สกุล Aviadenovirus
Adenoviruses เป็นไวรัส icosahedral ที่ไม่ห่อหุ้ม เส้นผ่านศูนย์กลางคือ 70–90 นาโนเมตร จีโนมของไวรัสแสดงด้วย DNA เส้นคู่เชิงเส้นที่มีน้ำหนักโมเลกุล 20–30 MDa
adenoviruses กลุ่ม II ถูกรวมเข้าด้วยกันโดยแอนติเจนกลุ่มทั่วไปซึ่งแตกต่างจากแอนติเจนของ adenoviruses กลุ่มที่ 1 อะดีโนไวรัสกลุ่มที่ 3 รวมถึงไวรัสกลุ่มอาการหยอดไข่ (EDS-76) ซึ่งไม่เกี่ยวข้องกับโรคกระเพาะลำไส้อักเสบในสัตว์ปีกในการเลี้ยงสัตว์ปีกเชิงอุตสาหกรรม adenoviruses กลุ่ม II ทำซ้ำได้ไม่ดีในการเพาะเลี้ยงเซลล์นกมาตรฐาน
ในระยะแรก ไวรัส GEI จะทำซ้ำในเซลล์ของระบบเรติคูโลเอนโดทีเลียม ปลูกในเซลล์เม็ดเลือดขาวและการเพาะเลี้ยงเม็ดเลือดขาวของไก่งวง
อุณหภูมิสูงและการสัมผัสกับสารฆ่าเชื้อหลายชนิดจะทำให้ไวรัสหยุดทำงาน อย่างไรก็ตาม สามารถทนต่อตัวทำละลายไขมัน (คลอโรฟอร์ม แอลกอฮอล์) และสามารถเก็บไว้ได้นานภายใต้อุณหภูมิที่กำหนด: 6 เดือนที่ 4°C และ 4 สัปดาห์ที่ 37°C ในซากสัตว์ปีก ไวรัสจะคงอยู่ที่อุณหภูมิ 37°C เป็นเวลาหลายสัปดาห์
เมื่อเปิดไก่งวง จะพบรอยโรคที่มีลักษณะเฉพาะเป็นหลักในม้ามและลำไส้ ม้ามจะขยายใหญ่ขึ้น โดยมีการพบจุดตกเลือดบนพื้นผิวของอวัยวะ เยื่อเมือกในลำไส้หลวม บวม โพรงเต็มไปด้วยสารหลั่งเลือด เยื่อบุผิวที่ด้านบนของวิลลี่เสื่อมสภาพ ส่วนบนของวิลลี่ถูกขัดออก และมีการตกเลือดในรูของลำไส้ นอกจากนี้ในม้ามพบว่ามีการเจริญเติบโตของเยื่อสีขาวและเนื้อร้ายของเซลล์เม็ดเลือดขาวและในบางกรณีการปรากฏตัวของการรวมลักษณะเฉพาะในนิวเคลียสของเซลล์ของระบบ reticuloendothelial กลไกการมีส่วนร่วมของไวรัสในการพัฒนาพยาธิวิทยาในลำไส้และการตกเลือดในนั้นยังไม่ชัดเจนทั้งหมดเนื่องจากไวรัส GEI ไม่ได้เพิ่มจำนวนในเยื่อบุผิวในลำไส้ ไวรัส GEI ได้รับการพิสูจน์แล้วว่าสามารถทำซ้ำได้ในเซลล์บุผนังหลอดเลือดในลำไส้ ซึ่งอาจนำไปสู่ความเสียหายของหลอดเลือดและเนื้อร้ายของวิลลัสในลำไส้ขาดเลือด สันนิษฐานว่ากลไกการออกฤทธิ์นี้เป็นลักษณะของการติดเชื้อ adenovirus ในวัว
ไวรัส GEI ติดต่อทางอุจจาระ-ช่องปาก ไวรัสสามารถคงอยู่ในขยะมูลฝอยที่ปนเปื้อนเป็นเวลานาน และดูเหมือนจะเป็นปัจจัยในการแพร่เชื้อไปยังฝูงไก่งวงตัวต่อๆ ไป การแพร่เชื้อทางกลของเชื้อโรคระหว่างฝูงนกที่ติดเชื้อและอ่อนแออาจเป็นเส้นทางสำคัญของการแพร่เชื้อไวรัส การแพร่กระจายของเชื้อโรคจากพาหะของไวรัส (รวมถึงเส้นทางผ่านรังไข่) รวมถึงพาหะของการแพร่กระจายของไวรัสยังไม่ได้รับการยืนยันแน่ชัด
การวินิจฉัยไวรัสลำไส้อักเสบจากริดสีดวงทวารอาจขึ้นอยู่กับจุลพยาธิวิทยา การแยกเชื้อไวรัส การศึกษาทางซีรั่มวิทยา และวิธีการตรวจหาแอนติเจน การวินิจฉัยทางจุลพยาธิวิทยาขึ้นอยู่กับการระบุลักษณะการรวมตัวของนิวเคลียร์ในเซลล์ของม้ามหรือลำไส้ การแยกไวรัสทำได้โดยการฉีดวัคซีนทางปากของม้ามหรือลำไส้ในลูกไก่อายุ 5-10 สัปดาห์ ตามกฎแล้วความตายจะเกิดขึ้น 3-6 วันหลังจากที่ติดเชื้อจากพยาธิสภาพ ไก่ที่ตายจะถูกตรวจสอบลักษณะของรอยโรค ไวรัสสามารถแยกได้จากการเพาะเลี้ยงเซลล์เม็ดเลือดขาวในไก่งวง สำหรับการวินิจฉัยทางเซรุ่มวิทยา สามารถใช้การทดสอบการตกตะกอนของเจลวุ้นหรือ ELISA ได้ สามารถตรวจพบไวรัสได้ในเนื้อเยื่อหรือเซลล์เพาะเลี้ยงโดยใช้ MFA, EM, การทดสอบการตกตะกอนของเจลวุ้น หรือ ELISA
สำหรับการป้องกัน BEI ในพื้นที่เฉพาะถิ่นจะใช้การฉีดวัคซีนรดน้ำด้วยสายพันธุ์ avirulent ของไวรัส BEI หรือไวรัส MSF รวมถึงไวรัสที่เกี่ยวข้องอย่างใกล้ชิดซึ่งไม่ก่อให้เกิดโรคสำหรับไก่งวง ปัจจุบันวัคซีนเชื้อเป็นสองชนิดถูกนำมาใช้กันอย่างแพร่หลายในการสร้างภูมิคุ้มกันให้กับไก่งวงโดยวิธีการรดน้ำ หนึ่งคือม้ามที่เป็นเนื้อเดียวกันอย่างหยาบซึ่งได้มาจากไก่อายุ 4-6 สัปดาห์ที่ติดเชื้อ GEI หรือ MSDV ในกระแสเลือด วัคซีนไวรัสชนิดมีชีวิตอีกทางเลือกหนึ่งสามารถเตรียมได้โดยการลดทอนสายพันธุ์ไวรัส GEI หรือ MSF ที่มีฤทธิ์ในการเพาะเลี้ยงเซลล์ลิมโฟบลาสต์ การสร้างภูมิคุ้มกันให้กับไก่งวงเมื่ออายุ 4-6 สัปดาห์ทำให้มั่นใจได้ถึงการสร้างภูมิคุ้มกันในระยะยาวที่มั่นคง ซึ่งรับประกันว่าจะปกป้องนกจากการติดเชื้อจากเชื้อที่แยกได้จากสนาม
แอสโตรไวรัส
ในปี 1980 McNulty และคณะ ภายใต้กล้องจุลทรรศน์อิเล็กตรอน แอสโตรไวรัสถูกตรวจพบครั้งแรกในลำไส้ของไก่งวงอายุ 11 วันที่มีอาการลำไส้อักเสบ เมื่อเร็วๆ นี้ Reynolds และคณะ แสดงให้เห็นว่าการติดเชื้อแอสโทรไวรัสในไก่งวงแพร่หลายในสหรัฐอเมริกา และพิสูจน์ให้เห็นถึงลักษณะของไวรัสเหล่านี้ที่ก่อให้เกิดโรคทางลำไส้
แอสโตรไวรัสเป็นกลุ่มไวรัสกลุ่มเล็กๆ ที่มีลักษณะทรงกลมและมีขนาดเล็ก ชื่อนี้มาจากคำภาษากรีกว่า "แอสตรอน" ซึ่งเป็นดาวฤกษ์ที่สะท้อนรูปร่างคล้ายดาวฤกษ์ของดาววิริออนซึ่งมีเส้นผ่านศูนย์กลาง 28–31 นาโนเมตร โครงสร้างทางชีวเคมีของแอสโตรไวรัสเป็นที่เข้าใจได้ไม่ดีเนื่องจากไม่สามารถปลูกฝังในหลอดทดลองได้
แอสโตรไวรัสเป็นที่แพร่หลาย ตามที่ผู้เขียนบางคนกล่าวไว้ ใน 80% ของฟาร์มสัตว์ปีกที่ทำการสำรวจ การติดเชื้อในลำไส้เกิดจากแอสโตรไวรัส การติดเชื้อแอสโตรไวรัสพบได้บ่อยในสัตว์อายุไม่เกินหนึ่งเดือน และพบน้อยกว่ามากในไก่งวงที่โตเต็มวัย อาการทางคลินิกจะแตกต่างกันไป เช่น ท้องร่วง กระสับกระส่าย ความอยากอาหารลดลง และอัตราการเจริญเติบโต การเจ็บป่วยมักจะสูง แต่อัตราการเสียชีวิตต่ำ
ในสัตว์ปีกที่ติดเชื้อ SPF ในการทดลอง น้ำหนักที่เพิ่มขึ้นลดลงและการดูดซับ D-xylose ลดลงเมื่อเปรียบเทียบกับกลุ่มควบคุม การทดลองติดเชื้อไก่ SPF ทำให้ความอยากอาหารลดลงท้องเสีย ในการชันสูตรพลิกศพการขยายตัวของ caecum สังเกตได้เนื่องจากการสะสมของมวลสีเหลืองฟองลดเสียงในลำไส้และความสม่ำเสมอของฟองของเนื้อหา เส้นทางหลักของการแพร่เชื้อไวรัสคืออุจจาระ-ปาก ส่วนเส้นทางอื่นยังไม่สามารถระบุได้
วิธีการหลักในการวินิจฉัยการติดเชื้อแอสโตรไวรัสคือกล้องจุลทรรศน์อิเล็กตรอนหรือ EM ภูมิคุ้มกันของตัวอย่างอุจจาระและลำไส้ เมื่อทำการศึกษาด้วยกล้องจุลทรรศน์อิเล็กตรอน จะต้องคำนึงว่าแอสโตรไวรัสสามารถสับสนกับไวรัสขนาดเล็กชนิดโค้งมนอื่น ๆ เช่นเอนเทอโรไวรัส การวินิจฉัย EM นั้นขึ้นอยู่กับขนาดของอนุภาคไวรัสและลักษณะทางสัณฐานวิทยาของโครงสร้างพื้นผิว ดังนั้น การวินิจฉัยการติดเชื้อแอสโตรไวรัสโดยใช้ EM ภูมิคุ้มกันจึงเป็นที่ต้องการมากที่สุด
ยังไม่มีการพัฒนามาตรการเฉพาะสำหรับการป้องกันการติดเชื้อแอสโทรไวรัส การควบคุมดำเนินการตามมาตรการป้องกันทั่วไป: การเปลี่ยนผ้าปูที่นอนทันเวลา การทำความสะอาดและการฆ่าเชื้อสถานที่เมื่อรับสัตว์ปีกชุดถัดไป
รีโอไวรัส
รีโอไวรัสในนกแพร่หลายอยู่ทั่วไป ปัจจุบัน มีการแยกและศึกษาซีโรไทป์ประมาณ 11 สายพันธุ์ เป็นครั้งแรกในปี พ.ศ. 2497 J.E. ฟาเฮย์และเจ.เอฟ. ครอว์ลีย์แยกรีโอไวรัสจากไก่ที่แสดงอาการของโรคระบบทางเดินหายใจ อาการทางคลินิกของโรคที่เกิดจากไวรัสรีโอไวรัสได้รับการอธิบายโดย P.J. Dalton R. และ Henry ในปี 1967 เรียกว่า tenosynovitis อย่างไรก็ตาม ยังมีอีกหลายประเด็นที่เกี่ยวข้องกับไวรัสในนกยังไม่เป็นที่เข้าใจ
ปัจจุบันวรรณกรรมได้รวบรวมข้อมูลเพียงพอเกี่ยวกับการแยก reoviruses ในกระบวนการทางพยาธิวิทยาต่าง ๆ ในไก่ซึ่งแสดงออกในรูปแบบของลำไส้อักเสบ, ไขข้ออักเสบ, กล้ามเนื้อหัวใจอักเสบ, เยื่อหุ้มหัวใจอักเสบ, ปีกมดลูกอักเสบ, อาการการดูดซึมไม่ดี, อาการขนนกไม่ดี ฯลฯ . อย่างไรก็ตาม ไม่มีเหตุเพียงพอที่จะพิจารณาว่าไวรัสในนกเป็นเพียงสาเหตุเดียวของโรคต่างๆ ที่มีอาการทางคลินิกที่แตกต่างกันดังกล่าว อาการเหล่านี้หลายอย่างมีอธิบายไว้ในโรคที่เกี่ยวข้องกับเชื้อโรคของการติดเชื้อไวรัสและแบคทีเรียอื่นๆ
รีโอไวรัสในสัตว์ปีกมีความเกี่ยวข้องกับโรคต่างๆ ในสัตว์ปีก รวมถึงโรคข้ออักเสบ/ทีโนซิโนอักเสบ โรคระบบทางเดินหายใจ ลำไส้อักเสบ และกลุ่มอาการ ดูดซึมไม่ได้ คนแคระ อย่างไรก็ตาม ยกเว้นโรคข้ออักเสบจากไวรัส/tenosynovitis บทบาททางสาเหตุของไวรัส reoviruses ในโรคเหล่านี้ยังคงไม่ได้รับการพิสูจน์ รีโอไวรัสในนกแพร่หลายไปทั่วโลก โดยมักถูกแยกออกจากขยะและเนื้อเยื่อของนกที่ไม่เพียงแต่เป็นโรคเท่านั้น แต่ยังรวมถึงนกที่มีสุขภาพดีทางคลินิกด้วย
รีโอไวรัสในนกมีความทนทานต่อสภาพแวดล้อมภายนอกและปัจจัยทางกายภาพและเคมีต่างๆ กิจกรรมการติดเชื้อของไข่แดงที่มีไวรัสไม่ลดลงที่ 60°C เป็นเวลา 8-10 ชั่วโมง, 56°C - 24 ชั่วโมง, 37°C - 16 สัปดาห์, 22°C - 51 สัปดาห์, 4°C - 3 ปี ลบ 20 °C - 4 ปี และลบ 63°C - สูงสุด 10 ปี ค่าไทเตอร์ของไวรัสที่ผ่านการทำให้บริสุทธิ์ไม่เพียงพอที่อุณหภูมิ 60°C จะลดลงภายใน 5 ชั่วโมง แต่จะไม่เกิดการหยุดทำงานโดยสมบูรณ์ เมื่อเชื้อโรคได้รับความร้อนเมื่อมีแมกนีเซียมคลอไรด์ กิจกรรมการติดเชื้อจะคงที่ การแช่แข็งและการละลายซ้ำๆ ไม่ส่งผลต่อกิจกรรมทางชีวภาพ Reoviruses ทนทานต่อรังสียูวี อีเธอร์ ทนต่อค่า pH ได้หลากหลาย แต่มีความไวต่อคลอโรฟอร์ม
reoviruses ของนกไม่ได้ห่อหุ้มไว้ โดยมีแบ็คโบน icosahedral capsid ขนาดเส้นผ่านศูนย์กลาง 50–70 นาโนเมตรสองตัว จีโนมแสดงด้วยส่วนเชิงเส้น 10–12 ส่วนของ RNA แบบเกลียวคู่โดยมีน้ำหนักโมเลกุลรวม 12–20 MDa การจำลองแบบและการประกอบของไวรัสนกเกิดขึ้นในไซโตพลาสซึม บางครั้งอาจมีการก่อตัวของการรวมตัวของพาราคริสตัลไลน์
รีโอไวรัสในนกมีแอนติเจนกลุ่มพื้นผิวทั่วไป ซึ่งโดยส่วนใหญ่แล้วจะถูกกำหนดใน MFA หรือโดยการตกตะกอนในเจลอะกาโรส จากการทดสอบการทำให้เป็นกลาง พบว่ามีความหลากหลายของแอนติเจนของรีโอไวรัสในนก ในขณะที่ตรวจพบ 11 สายพันธุ์ของเชื้อโรค ความแปรปรวนในการทำให้เกิดโรคของไวรัสรีโอไวรัสในนกก็ถูกสร้างขึ้นเช่นกัน
ด้วยการติดเชื้อรีโอไวรัส การแพร่กระจายของเชื้อโรคในแนวตั้งได้รับการพิสูจน์แล้ว ระดับการแพร่กระจายของไวรัสผ่านรังไข่ไม่มีนัยสำคัญ Reoviruses ที่อยู่บนพื้นผิวของเปลือกและภายในไข่สามารถมีส่วนร่วมในการแพร่เชื้อทั้งแนวนอนและแนวตั้ง
ในงานหลายชิ้นที่อุทิศให้กับการศึกษากลไกการเกิดโรคของการติดเชื้อไวรัสรีโอไวรัสในนก พบว่าลำไส้เป็นเป้าหมายหลักของไวรัส โดยไม่คำนึงถึงวิธีการแนะนำ หลังจากการติดเชื้อในช่องปากหรือ aerogenic เชื้อโรคจะเข้าสู่กระแสเลือดและเป็นผลมาจาก viremia แพร่กระจายไปยังอวัยวะและเนื้อเยื่อต่างๆอย่างรวดเร็ว โดยเฉพาะอย่างยิ่งไวรัสสามารถแยกได้จากลำไส้ เบอร์ซาของฟาบีเรียส ตับ ตับอ่อน หัวใจ ไต ข้อต่อ และเส้นเอ็น โจนส์ และคณะ แสดงให้เห็นว่า reoviruses ทำซ้ำครั้งแรกในเยื่อบุผิวของ villi ของลำไส้เล็กและเบอร์ซาของ Fabricius จากนั้นจึงแพร่กระจายไปยังอวัยวะอื่น ๆ กลุ่มอาการการดูดซึมผิดปกติมีลักษณะเฉพาะคือการขยายตัวของกระเพาะอาหารต่อมบางครั้งอาจมีเนื้อร้ายและสัญญาณของโรคลำไส้อักเสบจากโรคหวัด
เป็นที่ทราบกันดีว่า reoviruses มักแยกได้จากอาการลำไส้อักเสบหรือซินโดรม การดูดซึมผิดปกติ และกลุ่มอาการการตายที่เพิ่มขึ้นของนก อย่างไรก็ตาม ยังไม่มีการศึกษาบทบาททางสาเหตุในการทำให้เกิดโรคเหล่านี้อย่างครบถ้วน เป็นที่ยอมรับกันว่า reoviruses มีฤทธิ์กดภูมิคุ้มกันต่อสิ่งมีชีวิตของนกที่ป่วยและสิ่งนี้มีส่วนทำให้การก่อโรคของสารติดเชื้ออื่น ๆ เพิ่มขึ้นรวมถึง coccidia, Cryptosporidium spp. , Escherichia coli และสาเหตุของโรคโลหิตจางในสัตว์ปีก เป็นไปได้ว่าการกดภูมิคุ้มกันยังเป็นสาเหตุหนึ่งของอาการของโรคต่างๆ เช่น การดูดซึมผิดปกติ และเพิ่มกลุ่มอาการการตายของนก
การวินิจฉัยการติดเชื้อรีโอไวรัสขึ้นอยู่กับการแยกไวรัสในการเพาะเลี้ยงเซลล์และเอ็มบริโอของไก่ การวินิจฉัยโรคทางเซรุ่มวิทยาดำเนินการโดยใช้การทดสอบการวางตัวเป็นกลาง การทดสอบอิมมูโนฟลูออเรสเซนต์ทางอ้อม และ ELISA เพื่อตรวจหาแอนติบอดีจำเพาะกลุ่ม การวินิจฉัยย้อนหลังของการติดเชื้อ reovirus นั้นไม่ได้ให้ข้อมูลมากนักเนื่องจากมีการแพร่กระจายของไวรัสในวงกว้างและมีการติดเชื้อแบบไม่แสดงอาการ
เพื่อป้องกันการติดเชื้อในฟาร์มสัตว์ปีกจำเป็นต้องปฏิบัติตามกฎเกณฑ์ด้านสัตวแพทย์และสุขาภิบาล ระบอบการปกครอง "ทุกอย่างฟรี - ทุกอย่างยุ่ง" และหลักการแยกเชิงพื้นที่ของหน่วยและโซนการผลิต
ยาฆ่าเชื้อที่ดีที่สุดสำหรับห้องพักคือสารละลายด่างร้อน
พาโวไวรัส
เป็นที่รู้กันว่าพาร์โวไวรัสทำให้เกิดกระเพาะลำไส้อักเสบในสัตว์เลี้ยงลูกด้วยนมหลายชนิด โดยเฉพาะสุนัข แมว และวัว เชื่อกันว่าเป็นสาเหตุของโรคนี้ การดูดซึมผิดปกติ ในนกและลำไส้อักเสบในไก่งวง แต่บทบาทของพวกเขาในการเกิดโรคเหล่านี้ยังไม่ได้รับการยืนยันแน่ชัด
พวกมันไม่มีซองจดหมาย มีรูปร่างคล้ายไอโคซาฮีดรัล ขนาดของไวรัสคือ 18–26 นาโนเมตร และโครงสร้างพื้นผิวไม่แสดงออกมา ไวรัสประกอบด้วย DNA เส้นเดี่ยวเชิงเส้นที่มีน้ำหนักโมเลกุลประมาณ 20 MDa Parvoviruses ทำซ้ำในนิวเคลียสของเซลล์ซึ่งมักก่อให้เกิดการรวมตัว
การจำลองแบบของ Parvovirus ขึ้นอยู่กับปัจจัยที่เกิดขึ้นในเซลล์ระหว่างระยะ S ของวัฏจักรเซลล์ ดังนั้นการจำลองแบบและผลกระทบที่ทำให้เกิดโรคส่วนใหญ่เกิดขึ้นในเซลล์ที่มีการแพร่กระจายในระดับสูง การติดเชื้อ Parvovirus ของเซลล์ฝังศพใต้ถุนโบสถ์และเยื่อบุผิวในลำไส้ทำให้จำนวนเซลล์ดูดซับลดลงซึ่งหลุดออกจากยอดของวิลลี่ ความเสียหายต่อวิลลี่ทำให้เซลล์ฝ่อ ความสามารถในการดูดซับลดลง และเกิดอาการท้องร่วง
มีการอธิบาย Parvoviruses ในไก่และไก่งวง แต่การทำให้เกิดโรคของไวรัสเหล่านี้และบทบาทของพวกมันในฐานะที่เป็นสาเหตุของโรคกระเพาะและลำไส้อักเสบในสัตว์ปีกเหล่านี้ยังไม่ชัดเจนนัก คิซารี และคณะ อธิบายพาร์โวไวรัสและไวรัสที่คล้ายกันในไก่ ไวรัสถูกระบุว่าเป็นพาร์โวไวรัสโดยพิจารณาจากสัณฐานวิทยา ขนาด ความหนาแน่นใน CsCl (1.42 ถึง 1.44 กรัม/มิลลิลิตร) และการมีอยู่ของ DNA สายเดี่ยว (ขนาดประมาณ 5.2 กิโลไบต์)
การทดลองติดเชื้อในไก่เนื้ออายุ 1 วัน ทำให้เกิดอาการท้องร่วง น้ำหนักตัวลดลง 40% และพัฒนาการช้าลง อย่างไรก็ตาม ในการทดลองที่ดำเนินการโดย Decaesstestecker และคณะ ไม่มีการแสดงอาการทางคลินิกและน้ำหนักที่เพิ่มขึ้นลดลง เช่นเดียวกับในการทดลองการติดเชื้อ Parvovirus SPF-ไก่และไก่เนื้อ
การวินิจฉัยการติดเชื้อพาร์โวไวรัสดำเนินการโดยใช้ EM และ MFA สำหรับการวิจัยใน EM เนื้อหาของลำไส้จะถูกทำให้บริสุทธิ์เบื้องต้นด้วยการไล่ระดับ CsCl เพื่อให้ปราศจากไวรัสขนาดเล็กอื่นๆ นอกจากนี้ยังจำเป็นต้องทำการศึกษาทางชีวเคมีเพื่อศึกษาจีโนมของไวรัสด้วย MFA เป็นวิธีการวินิจฉัยที่ง่ายและรวดเร็ว อย่างไรก็ตาม การผลิตจำเป็นต้องมีแอนติซีรัมเฉพาะซึ่งไม่สามารถทำได้เสมอไป
แทรมเบล และคณะ บรรยายถึงไวรัสที่มีลักษณะคล้ายพาร์โวไวรัสในไก่งวง เชื้อก่อโรคทำให้เกิดอาการลำไส้อักเสบในสัตว์ปีกไก่งวงอายุ 1-5 สัปดาห์ มันถูกระบุโดยอาศัยการตรวจจับทางจุลพยาธิวิทยาของการรวมนิวเคลียร์ในเอนเทอโรไซต์ในลำไส้ เช่นเดียวกับการตรวจจับอนุภาคหกเหลี่ยม 15–20 นาโนเมตรโดยใช้ EM ชั้นบาง
ในการทำให้บริสุทธิ์ การหมุนเหวี่ยง ในครอกของนกป่วย สามารถตรวจพบไวรัสได้ด้วยกล้องจุลทรรศน์อิเล็กตรอน การศึกษารอยเปื้อนในอุจจาระและส่วนของเยื่อเมือกของลำไส้เล็กด้วยกล้องจุลทรรศน์อิมมูโนอิเล็กตรอนสามารถเปิดเผยแอนติเจนของไวรัสได้
รายการวรรณกรรม
1. แอนเดอร์สัน เอ.เอ. ใน: การวินิจฉัยเปรียบเทียบโรคไวรัส. 2524. สำนักพิมพ์วิชาการ, นิวยอร์ก, นิวยอร์ก, หน้า 4–66
2. Andral B., Toquin D. การสังเกตและ isoelements de psendopicornavirus a partir de dindonneaux ma lades // Avian Pathol, 1984 13:377–388.
3. บาร์นส์ เอช.เจ. ใน: โรค Poultrv. ฉบับที่ 10 2540 สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา เอมส์ ไอโอวา ป. 683–686
4. Barnes H.J., Guy J. ใน: โรคสัตว์ปีก. ฉบับที่ 10 1997. สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา, เอมส์, ไอเอ. หน้า 1023–1031
5. เบนฟิลด์ ดี.เอ. ใน: โรคอุจจาระร่วงของมนุษย์และสัตว์. 1990. สำนักพิมพ์ CKC, โบคา ราตัน, ฟลอริดา หน้า 113–133.
6. Bergeland M.E., McAdaragh J.P., Stotz I. Rotaviral enteritis ในสัตว์ปีกไก่งวง ใน: รายงานการประชุมโรคสัตว์ปีกตะวันตก ครั้งที่ 26. 1977 หน้า 129–130.
7. เบิร์นส์ เค.ไอ. การจำลองแบบ Parvovirus // Micro รายได้ 1990. 54: 316–329.
8. บริดเจอร์ เจ.ซี. ใน: โรคอุจจาระร่วงของมนุษย์และสัตว์. 1990. สำนักพิมพ์ CRC, โบกา ราตัน, ฟลอริดา หน้า 161–182.
9. Cavanagh D. โพลีเปปไทด์โครงสร้างของโคโรนาไวรัส 1BV // J. Gen. วิรอล. 1981. 53:93–103.
10. Chooi K.F., Chilian U. Broiler runting/stunting syndrome ในมาเลเซีย, Vet. ฉบับที่ 1985 116:354.
11. Dea S., Marsolais G., Beaubien J., Ruppanner R. Coronares ที่เกี่ยวข้องกับการระบาดของโรคลำไส้อักเสบที่ติดต่อได้ของไก่งวงในควิเบก: คุณสมบัติการเกิดเม็ดเลือดแดงและการเพาะเลี้ยงเซลล์ // Avian Dis., 1986. 30:319–326.
12. Decaesstecker M.. Charlier G., Meulemans G. ความสำคัญของพาร์โวไวรัส, ไวรัสที่มีลักษณะคล้าย entero และ reoviruses ในสาเหตุของโรคการดูดซึมของไก่ // Avian Pathol., 1986. 15:769–782.
13. Engstrom B.E., Fossum O., Luthman, Bluenving M. D isease: การทดลองการติดเชื้อด้วยเชื้อโรคโลหิตจางในไก่ที่แยกได้ของสวีเดนในฐานะ Reovirus สำหรับนก // Avian Pathol เจ. 1988. 17:33–50.
14. เอสเตส เอ็ม.เค. ใน: ไวรัสวิทยา. ฉบับที่ 2 2533 สำนักพิมพ์กา นิวยอร์ก, นิวยอร์ก ป. 1329–1352.
15. Fadly A.M., Nazerian K., Nagaraja K., ด้านล่าง G. การฉีดวัคซีนป้องกันลำไส้อักเสบจากไก่งวง // Avian Dis., 1985. 29:768–777
16. กู๊ดวิน ม.อ. Adenovirus รวม body ventriculitis ในไก่และนกกระทา bobvvhite เชลย (Colinus virginianus) // Avian Dis., 1993. 37:568–571.
17. Goodwin M.A., Hill D.L., Dekich M.A., Putnam M.R.. การติดเชื้อ adenovirus หลายระบบในลูกไก่เนื้อที่มีภาวะน้ำตาลในเลือดต่ำและการตายที่เพิ่มขึ้น // Avian Dis., 1993. 37:625–627.
18. Guy J.S. , Levy M.G. , Ley D.H. , Bamesrand H.J. , Cerig T. M. การสืบพันธุ์แบบทดลองของลำไส้อักเสบในนกกระทา bobwhite (Colinus virginianus) ด้วย Cryptosporidium และ Reovirus // Avian Dis. 1987. 31:713–722.
19. Guy ].S., Barnes H.J. ลักษณะบางส่วนของไวรัสที่มีลักษณะคล้ายเอนเทอโรไวรัสไก่งวง // Avian Dis., 1991. 35:197–203.
20. Guy J., Barnes H.J., Smith L.G., Breslin J. การแสดงลักษณะเฉพาะของแอนติเจนของโคโรนาไวรัสที่ระบุในลำไส้อักเสบจากสัตว์ปีกและไก่งวงที่ได้รับผลกระทบจากโรคซินโครมตาย // Avian Dis., 1997. 41:583–590.
21. Hayhow C.S., Saif Y.M., Kerr K.M., Whitmover R.E.. การสังเกตเพิ่มเติมเกี่ยวกับการติดเชื้อ enterovirus ในสัตว์ปีกไก่งวงปลอดเชื้อโรคโดยเฉพาะ // Avian Dis. 1993. 37: 124–134.
22. เฮย์ฮาว ซี.เอส., วี.เอ็ม. ซาอิฟ. การห่อหุ้มของการทดสอบอิมมูโนซอร์เบนท์ที่เชื่อมโยงกับแอนติเจนในการจับเอนไซม์เพื่อตรวจหาเอนเทอโรไวรัสในไก่งวงเชิงพาณิชย์ // Avian Dis., 1993. 37:375–379.
23. โจ๊กลิก ไอ.วี.เค. โครงสร้างและหน้าที่ของจีโนมรีโอไวรัส // ไมโคร รายได้ 1981. 45:483–501.
24. โจนส์ อาร์. อิสลาม ซี.เอ็ม.อาร์. เคลลี่ ดี.เอฟ. การเกิดโรคในระยะเริ่มแรกของการติดเชื้อไวรัสรีโอไวรัสในไก่ // Avian Pathol., 1989. 18:239–253.
25. คิเบ็นเก้ เอฟ.เอส.บี., เกว จี.อี., โจนส์ อาร์.ซี., แชปแมน เอ.พี., ซาเวจ ซี.อี. การติดเชื้อรีโอไวรัสแบบทดลองในไก่: การสังเกตการแพร่กระจายของไวรัสและไวรัสในระยะเริ่มแรกในไขกระดูก ตับ และเนื้อเยื่อลำไส้ // Avian Pathol., 1985. 14:87–98.
26. Kisary J., Nagy B., Bitay Z.. การมีอยู่ของ par-Vovifuses ในลำไส้ของไก่ที่แสดงอาการแคระแกรน // Avian Pathol., 1984. 13:339–343.
27. Kisary J. การติดเชื้อจากการทดลอง oi เอ็มบริโอไก่และไก่อายุ 1 วันที่มีพาร์โวไวรัสจากไก่ // Avian Pathol., 1985. 14:1–7
28. Kisary J. อิมมูโนฟลูออเรสเซนต์ทางอ้อมเป็นเครื่องมือวินิจฉัยการติดเชื้อพาร์โวไวรัสของไก่ // Avian Pathol., 1985. 14: 269–273
29. Kisary J., Avalosse B., Miller-Faures A., Rommelaere J.. จีโนมของไวรัสไก่ตัวใหม่ระบุว่าเป็นพาร์โวไวรัส // J. Gen. ไวโรล. 1985. 66:2259–2263.
30. Kouvvenhoven B., Daveiaar F.G., J. Van Yvalsum. โรคเยื่อหุ้มสมองอักเสบติดเชื้อทำให้เกิดการวิ่งในไก่เนื้อ // Avian Pathol. 1978. 7:183–187.
31. แมคเฟอร์แรน เจ.บี. ใน: โรคสัตว์ปีก. ฉบับที่ 10 2540 สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา เอมส์ ไอโอวา ป. 607–620.
32. แมคนัลตี้ M.S. ใน: โรคสัตว์ปีก. ฉบับที่ 10 2540 สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา เอมส์ ไอโอวา ป. 692–701.
33. แมคนัลตี เอ็ม.เอส. แมคเฟอร์แรน เจ.บี. ใน: การติดเชื้อไวรัสของสัตว์มีกระดูกสันหลัง. ฉบับ 4. 1993. สำนักพิมพ์ Elsevier Science, นิวยอร์ก, นิวยอร์ก ป. 519–529.
34. McNulty M S., Guy J.S. ใน: โรคสัตว์ปีก. ฉบับที่ 10 2540 สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา เอมส์ ไอโอวา ป. 706–710.
35. McNulty M.s., Allan G.M., Todd D., McFerran B.. การแยกและการเพาะเลี้ยงเซลล์ oi โรตาไวรัสจากไก่งวงและไก่ // Arch. Virol., 1979a. 61:13–21.
36. McNulty M.S., Curran W.L., Todd D., McFerran J.B.. การตรวจหาไวรัสในอุจจาระนกด้วยกล้องจุลทรรศน์อิเล็กตรอนโดยตรง // Avian Pathol. 1979b. 8:239-247.
37. McNulty M.S., Curran VV.L., McFerran J.B.. การตรวจหาแอสโตรไวรัสในอุจจาระไก่งวงโดยกล้องจุลทรรศน์อิเล็กตรอนแบบตรง, สัตวแพทยศาสตร์ ฉบับปี 1980 106:561.
38. McNulty M.S., Allan G.M., Todd D., McFerran J.B., McCracken M.. การแยกจากไก่ของโรตาไวรัส 1 ขาดแอนติเจนกลุ่มโรตาไวรัส เจ.เจน. วิโรล., 1981. 55: 405–413.
39. McNulty M.S., Allan G.M., McCracken R.M.. การติดเชื้อทดลองในไก่ที่มีโรตาไวรัส: การค้นพบทางคลินิกและไวรัสวิทยา // Avian Pathol., 1983. 12:45–54.
40. McNulty M.S., Allan G.M., McFerran J.B.. การแยกไวรัสคล้ายนก entero ชนิดใหม่ // Avian Pathol., 1987. 16:331–337.
41. มูน H.W. กลไกการเกิดโรคท้องร่วง: บทวิจารณ์ // J. Am. สัตวแพทย์ ยา รศ. 1978.172:443–446.
42. Xazerian K., Fadly A.M.. การขยายพันธุ์มีความรุนแรงและไวรัสลำไส้อักเสบจากไก่งวงที่มีความรุนแรงในการเพาะเลี้ยงเซลล์ // Avian Dis., 1982. 26:816–827
43. อ.เจ.พี. ลำไส้อักเสบเนื้อตายในลูกวัวที่ติดเชื้อ adenovirus // Can. สัตวแพทยศาสตร์, 1984. 25:72.
44. Panigrahy B., Nacji S.A., Hall C.F.. การแยกและลักษณะของไวรัส oi ที่เกี่ยวข้องกับโรคลำไส้อักเสบที่ถ่ายทอดได้ (bluecomb) oi ไก่งวง // Avian Dis. 1973. 17:430–438.
45. Paradiso P.R., Rhone S.L., นักร้อง I.I. Canine parvovirus: ลักษณะทางชีวเคมีและโครงสร้างพิเศษ // J. Gen. วิรอล. 1982. 62:113–125.
46. เพียร์สัน เอฟ.วี., โดเมอร์มูธ เอส.เอ็น. ใน: โรคสัตว์ปีก. ฉบับที่ 10 2540 สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา เอมส์ ไอโอวา ป. 624–633.
47. Pomeroy B.S., Larson C.T., Deshmukh D.R., Patel B.L.. ภูมิคุ้มกันต่อการแพร่กระจายของลำไส้อักเสบของไก่งวง (bluecomb) // Am. เจ.สัตวแพทย์. Res., 1975. 36:553–555.
48 Pomeroy B.S. และ K.V. Xagaraja. ใน: โรค oi สัตว์ปีก. ฉบับที่ 9 1991. สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา, เอมส์, ไอเอ. หน้า 621–627
49. เรย์โนลด์ส ดี.แอล, ไซฟ ดับเบิลยู.วี. Astrovirus: สาเหตุของโรคลำไส้ในสัตว์ปีกไก่งวง // Avian Dis., 1986.30:89–98.
50. Reynolds D.L, Saif Y.M., Theil K.VV. การสำรวจไวรัสในลำไส้ของสัตว์ปีกไก่งวง // Avian Dis. , 1987. 31:89–98.
51. เรย์โนลด์ส ดี.แอล. ใน: โรคสัตว์ปีก. ฉบับที่ 10 2540 สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา เอมส์ ไอโอวา ป. 701–705.
52. ไรน์ฮาร์ต ซี.แอล, โรเซนเบอร์เกอร์ เจ.เค. ผลของไวรัสนกต่อการตอบสนองทางภูมิคุ้มกันของไก่ // Poultry Sci., 1983. 62:1488–1489.
53. Ritchie A.E., Desmukh D.R., Larsen C.T., Pomeroy B.S.. กล้องจุลทรรศน์อิเล็กตรอนของโคโรนาไวรัสเช่นอนุภาคที่มีลักษณะเฉพาะของโรคบลูคอมบ์ไก่งวง // Avian Dis., 1973. 17: 546–558
54 โรเซนเบอร์เกอร์ เจ.เค. เอ็น.โอ. โอลสัน. ใน: โรคสัตว์ปีก. ฉบับที่ 10 2540 สำนักพิมพ์มหาวิทยาลัยแห่งรัฐไอโอวา เอมส์ ไอโอวา ป. 711–719.
55. Rosenberger J.K., Fries P.A., Cloud S.S., Wilson R.A. การจำแนกลักษณะเฉพาะของนกในหลอดทดลองและในร่างกายของ Escherichia coli ครั้งที่สอง ปัจจัยที่เกี่ยวข้องกับการทำให้เกิดโรค // Avian Dis., 1985. 29:1094–1107.
56. Ruff M.D., Rosenberger J.K. การติดเชื้อพร้อมกันกับ reoviruses และ coccidia ในไก่เนื้อ // Avian Dis., 1985. 33: 535–544
57. Saif L.J., Saif Y.M., Theil K.VV. ไวรัสในลำไส้ในสัตว์ปีกไก่งวงที่มีอาการท้องร่วง // Avian Dis., 1985. 29:798–811.
58. Saif Y.M, Saif L.J., Hofacre C.L., Hayhow C, Swayne D.E., Dearth R.N.. ไวรัสกลมเล็กที่เกี่ยวข้องกับลำไส้อักเสบในสัตว์ปีกไก่งวง // Avian Dis., 1989. 34:762–764.
59. Spackman D., Gough R.E., Collins M.S. การแยกสารคล้ายเอนเทอโรไวรัสออกจากมีโคเนียมของตัวอ่อนไก่ที่ตายแล้ว // สัตวแพทย์ Rec., 1984. 114: 216–218.
60. Swayne D.E., Radin M.J., Saif Y.M. โรคลำไส้ในสัตว์ปีกไก่งวงปลอดเชื้อโรคเฉพาะที่ฉีดวัคซีนด้วยไวรัสลำไส้เล็กที่มาจากไก่งวง // Avian Dis., 1990. 34: 683–692
61. Theil K.W. และ Y. M. Saif. การติดเชื้อที่เกี่ยวข้องกับอายุด้วยโรตาไวรัส ไวรัสโรตาไวรัส และโรตาไวรัสที่ผิดปกติในฝูงไก่งวง // เจ.คลิน. ไมโครไบโอล., 1987. 25:333–337.
62. Thei K.W. , Reynolds D.L. , Sail Y.M. การเปรียบเทียบกล้องจุลทรรศน์อิเล็กตรอนแบบภูมิคุ้มกันและเทคนิค eloc-tropherotyping ของจีโนมสำหรับการตรวจหาไวรัสโรตาไวรัสไก่งวงและไวรัสที่มีลักษณะคล้ายโรตาไวรัสในลำไส้ // J. Clin ไมโครไบโอล., 1986. 23:695–699.
63. Tiorsen J., Weninger N., Weber L., Van Dijk C. การทดลองภาคสนามเกี่ยวกับขั้นตอนการสร้างภูมิคุ้มกันโรคลำไส้อักเสบจากไก่งวง // Avian Dis., 1982. 26:473–477.
64. Trambel D.W., Kinden D.A., Solorzano R.F., StogsdilI P.L.. enteropathy เหมือน Parvovirus ในไก่งวงมิสซูรี // Avian Dis., 1982. 27:49–54.
65. V an der Heide L., Kalbac M. tenosynovitis ที่ติดเชื้อ (โรคข้ออักเสบจากไวรัส): อิทธิพลของแอนติบอดีของมารดาต่อการพัฒนาของรอยโรค tenosynovitis หลังจากการทดลองติดเชื้อในไก่อายุหนึ่งวันที่มีไวรัส tenosynovitis // Avian Dis., 1975. 20:641 –648,
66. เวเกอ เอช., ซิดเดล เอส., วี. เดอร์ มิวเลน. ชีววิทยาและเชื้อโรคของโคโรนาไวรัส // Curr. สูงสุด. ไมโครไบโอล อิมมูนอล., 1982. 99: 165–200.
67. Wigand R., Bartha A., Dreizin R.S., Esche H., Ginsberg H.S., Green M., Hierholzer J.C., Kalter S.S., McFerran J.B., Pettersson U., Russell W.C., Wadell G.. Adenoviridae: รายงานฉบับที่สอง อินเตอร์ไวรอล 1982. 18:169–176.
68. Wood G.VV., Nicholas R.A.J., Hebert C.N., Thornton D.H.. การเปรียบเทียบทางเซรุ่มวิทยาของ reoviruses ในนก // J. Col. ปทุม. 1980. 90:29–38.
69. Yason C.V., Schat K.A.. กลไกการเกิดโรคของการติดเชื้อโรตาไวรัสในสัตว์ปีกไก่งวง // Avian Pathol., 1986 15:421–435.