În 1906, Rutherford a descoperit împrăștierea particulelor α. Metoda lui Rutherford a fost următoarea. Un fir acoperit cu radiu C a fost plasat într-o adâncitură dintr-o bucată de plumb. O fantă îngustă a fost plasată deasupra sârmei; Particulele α care trec prin această fantă au căzut pe o placă fotografică. Toate acestea au fost plasate într-un cilindru de alamă, din care a fost pompat aer. Cilindrul a fost plasat între polii unui electromagnet, ale cărui linii de forță erau paralele cu firul. Dungile rezultate pe placa fotografică au fost puternic limitate în gol. Dacă cilindrul era umplut cu aer, atunci dungile erau mai largi și marginile lor erau încețoșate. Dacă golul este acoperit cu un strat subțire de substanță, dungile devin mai largi și intensitatea lor scade treptat de la centru spre margini.
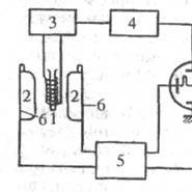
În 1909-1910 G. Geiger a studiat cu atenție împrăștierea particulelor α folosind metoda scintilației. Dispozitivul Geiger este prezentat într-o figură preluată din articolul lui Geiger, 1910. Radonul este introdus într-un tub conic L, închis cu un strat subțire de mică, și rămâne în el timp de câteva ore. Radonul este apoi aspirat în vasul B și, la scurt timp, toate particulele a sunt ejectate de radiu: C depus pe pereții tubului. Slit D selectează din fluxul de particule α emis de radiu C un fascicul îngust, care oferă o imagine strălucitoare a scintilațiilor de pe ecranul de sulfură de zinc S. Dacă o placă subțire a substanței studiate este apoi plasată în E, scintilațiile pe ecranul sunt reduse din cauza împrăștierii particulelor α. Rezultatele experimentului sunt prezentate prin curbe, unde unghiurile de împrăștiere sunt reprezentate de-a lungul axei absciselor, iar numărul de particule împrăștiate la un unghi dat este reprezentat de-a lungul axei ordonatelor. Din experimentele lui Geiger rezultă că:
- Unghiul de împrăștiere cel mai probabil (adică unghiul pentru care numărul de particule împrăștiate este cel mai mare) crește pentru grosimi mici aproximativ proporțional cu rădăcina pătrată a grosimii substanței pătrunse de particule α. Pentru grosimi mai mari, împrăștierea crește mult mai repede.
- Unghiul cel mai probabil la care o particulă este deviată atunci când trece printr-un atom este proporțional cu greutatea atomică. Valoarea reală a acestui unghi în cazul unui atom de aur este de aproximativ 1/200 de grad.
- Cel mai probabil unghi de împrăștiere crește rapid odată cu scăderea vitezei particulei α, fiind, la o primă aproximare, invers proporțional cu cubul vitezei.
Cel mai frapant fenomen observat în timpul împrăștierii particulelor α a fost un fapt descoperit în 1909. GeigerȘi Marsden, că o parte mică a particulelor sunt împrăștiate la unghiuri foarte mari, astfel încât particulele zboară înapoi spre sursă. Pentru particulele alfa emise de radiu C, aproximativ una din 8000 de particule este împrăștiată la un unghi mai mare decât unghiul drept.

Cum să explic acest fapt? Presupunând că atomul are structura propusă D. D. Thomson, atunci deviațiile unice ale unei particule α la ciocnirea cu un astfel de atom sunt foarte mici, iar unghiurile mari de împrăștiere pot fi interpretate ca un efect cumulativ rezultat din multe deviații. Calculele efectuate de Thomson și Rutherford înșiși au arătat că, chiar și cu un număr mai mare de ciocniri, deviația rezultată a particulei α ar trebui să fie foarte mică. „Am arătat”, scria Rutherford în 1914, „că modelul atomului propus de Lord Kelvin și elaborat în detaliu de Sir D. D. Thomson nu poate da abateri atât de mari decât dacă se presupune că diametrul sferei pozitive este extrem de mic. .” .
Necesitatea de a interpreta rezultatele experimentelor lui Geiger și Marsden l-a condus pe Rutherford la modelul nuclear al atomului. El a raportat pentru prima dată descoperirea sa într-o lucrare „Răspândirea razelor α și β și structura atomului”, citită la Societatea Filozofică din Manchester pe 7 martie 1911. Prezentăm acest mesaj în întregime, având în vedere enormul său istoric. semnificaţie.
"Este bine cunoscut faptul că particulele α și β se vor abate de la căile lor drepte în timpul coliziunilor cu atomii de materie. Împărțirea particulelor β datorită momentului lor mic (adică impulsului - P.K.) și energiei în general este mult mai mare, decât deviația particulelor α. Pare sigur că aceste particule care se mișcă rapid trec prin sistemul atomic și un studiu detaliat al deviațiilor care apar ar trebui să arunce lumină asupra structurii electrice a atomului. În general, se presupune că împrăștierea observată este rezultatul multor mici împrăștieri.Domnule D. D. Thomson (Proc. Camb. Phil. Soc. 15, p. 5, 1910) a avansat recent teoria micilor împrăștieri, iar principalele concluzii ale teoriei au fost verificate experimental Grouter (Proc. Roy. Soc. 84, p. 226, 1910). Conform acestei teorii, atomul se presupune că este format dintr-o sferă electrificată pozitiv care conține o cantitate egală de electricitate negativă sub formă de corpusculi. Când a comparat teoria cu experimentul, Grouter a concluzionat că numărul de corpusculi dintr-un atom este de aproximativ trei ori mai mare decât greutatea sa atomică, exprimată în greutatea hidrogenului. Cu toate acestea, există o serie de experimente de împrăștiere care arată că particulele α și β experimentează uneori deviații de peste 90° într-o singură coliziune. De exemplu, Geiger și Marsden (Proc. Roy. Soc. 82, p. 493, 1909) a constatat că o mică parte din particulele α care cad pe o foiță de aur subțire suferă o deviație mai mare decât un unghi drept. O abatere atât de mare nu poate fi explicată prin teoria probabilității, ținând cont de împrăștierea mică observată experimental. Se pare cu siguranță că aceste deviații mari apar într-o singură coliziune atomică.
Pentru a explica aceste și alte rezultate, este necesar să presupunem că particulele electrificate trec printr-un câmp electric intens în atom. Imprăștirea particulelor încărcate poate fi explicată prin presupunerea unui atom care constă dintr-o sarcină electrică centrală concentrată într-un punct și înconjurat de o distribuție sferică uniformă a electricității opuse de mărime egală. Cu această aranjare a atomului, particulele α și β, atunci când trec la o distanță apropiată de centrul atomului, experimentează deviații mari, deși probabilitatea unei deviații mari este mică. Conform acestei teorii, fracția din numărul total de particule încărcate care suferă o abatere între unghiurile Ф și Ф+dФ este dată de expresia

unde n este numărul de atomi pe unitate de volum a materialului de împrăștiere, t este grosimea mică presupusă a materialului și ![]() unde Ne este sarcina din centrul atomului, E este sarcina particulei electrificate, m este masa acesteia și u este viteza sa.
unde Ne este sarcina din centrul atomului, E este sarcina particulei electrificate, m este masa acesteia și u este viteza sa.
Rezultă că numărul de particule împrăștiate pe unitate de suprafață pentru o distanță constantă de la punctul de incidență a unui fascicul de raze variază ca cosec 4 Ф / 2. Această lege de distribuție a fost testată experimental de Geiger pentru particule α și s-a dovedit a fi valabil în limitele erorilor experimentale.
Dintr-o discuție despre rezultatele generale ale împrăștierii de către diferite materiale, s-a constatat că sarcina centrală a unui atom este foarte strâns proporțională cu greutatea sa atomică. Sarcina exactă a nucleului central nu a fost determinată, dar pentru un atom de aur este de aproximativ 100 de unități de sarcină.”
Într-o formă atât de clară și concisă din punct de vedere clasic, lumea a aflat despre una dintre cele mai mari descoperiri din istoria științei.
Doi ani mai târziu, Rutherford a descris mai detaliat munca sa și munca colaboratorilor săi, care a dus la descoperirea modelului nuclear al atomului, în cartea „Substanțe radioactive și radiațiile lor”.
Iată calcule care fac posibilă determinarea numărului de particule α împrăștiate la un unghi φ față de direcția inițială a fasciculului:

unde n este numărul de atomi pe unitate de volum a substanței de împrăștiere, t este grosimea plăcii de împrăștiere, Q este numărul de particule α incidente pe unitatea de suprafață a plăcii de împrăștiere, r este distanța de la sursă la ecran, b este valoarea determinată de egalitate

unde Ne este sarcina nucleului de împrăștiere, E este sarcina particulei α, m este masa acesteia, V este viteza.
Legea lui Rutherford ne permite nu numai să verificăm validitatea ipotezei structurii nucleare a atomului, ci și să determinăm sarcina nucleului (Ne). Geiger a început imediat să-l testeze în același an, 1911. Experimentul a confirmat validitatea legii cosec 4 φ / 2 și a indicat că mărimea sarcinii este aproximativ proporțională cu greutatea atomică. În 1913, Geiger și Marsden au întreprins un nou test experimental al formulei lui Rutherford folosind metoda scintilației. "A fost o lucrare foarte dificilă și minuțioasă", a scris Rutherford, "deoarece au trebuit numărate multe mii de particule. Rezultatele lui Geiger și Marsden sunt de acord foarte strâns cu teoria."
Iată câteva date de la Geiger și Marsden.
Cu o modificare a vitezei V și alți parametri constanți, formula lui Rutherford dă că yV 4 = const. Date Geiger-Marsden:
>
1 / V 4 (Valoare relativă) 1,0 1,21 1,50 1,91 2,84 4,32 9,22
Pentru dependența de unghi, formula lui Rutherford dă

Potrivit lui Geiger și Marsden,

Și, în sfârșit, pentru dependența de sarcină (Ne), formula lui Rutherford oferă constanța rapoartelor v" / A 2, unde A este greutatea atomică, v" = v / nt - "numărul redus de scintilații". Potrivit lui Geiger și Marsden,

„Geiger și Marsden au descoperit”, subliniază Rutherford, „că împrăștierea de către diferiți atomi a unei substanțe este aproximativ proporțională cu pătratul greutății atomice, din care rezultă că sarcina atomului este aproximativ proporțională cu greutatea atomică. După ce au determinat numărul de particule α împrăștiate de pelicule subțiri de aur, au ajuns la concluzia că sarcina nucleară este aproximativ egală cu jumătate din greutatea atomică înmulțită cu sarcina electronului. Din cauza dificultăților experimentului, numărul real a putut fi determinat doar cu o precizie care nu depășește 20%.
„Astfel”, încheie Rutherford prezentarea rezultatelor experimentelor lui Geiger și Marsden, „rezultatele experimentale ale lui Geiger și Marsden s-au dovedit a fi în total acord cu predicțiile teoriei și au indicat că ipoteza pe care am făcut-o despre structura a atomului este corectă în cele mai simple trăsături.” Este interesant de remarcat că încă în 1913, Rutherford a acceptat sarcina nucleului ca fiind egală cu +Ne, adică a permis posibilitatea încărcării atât pozitive, cât și negative a nucleului. Într-adevăr, mecanica de deviere permite atât sarcina pozitivă, cât și negativă a atomului. Dar o serie de fapte, și în special studiile lui D. D. Thomson cu raze pozitive, pe care le vom discuta în scurt timp, au arătat că purtătorii de electricitate pozitivă sunt întotdeauna asociați cu o masă mai mare sau egală cu masa atomului de hidrogen. Un nucleu masiv poate transporta doar sarcini pozitive. Adevărat, deja în 1913 Bohr a ajuns la concluzia că nucleul trebuie să conțină și electroni. Această ipoteză a fost exprimată pentru prima dată de Marie Skłodowska-Curie. În orice caz, până în 1913, legătura dintre sarcina nucleului și numărul ordinal al elementului din tabelul periodic a fost în sfârșit clarificată (van den Broek, Moseley).
Experimentele clasice privind studiul structurii atomului au fost efectuate de Sir Ernest Rutherford în 1911. Rutherford a efectuat experimente pentru a studia împrăștierea particulelor alfa prin foi subțiri de folie metalică. Impactul asupra atomilor a fost realizat prin bombardarea lor cu un fascicul de particule masive. Diagrama experimentală este prezentată în Fig. 1.
Folie subțire de aur F (grosimea foliei era de aproximativ 10 -7 m, pe ea erau plasați aproximativ 400 de atomi) a fost plasată în interiorul unui ecran sferic E. Printr-o gaură din ecran, un fascicul de particule alfa rapide emis de un radioactiv. medicamentul conținut într-un recipient de plumb a căzut perpendicular pe placa R. Particulele alfa sunt un atom de heliu complet ionizat cu o masă egală cu 4,0015 amu. și taxa egală cu + 2e
 (e este valoarea sarcinii electrice elementare). Viteza particulei alfa a fost de ordinul 107 m/s, energia a fost de 4,05 MeV. Când grosimea foliei este mică, ciocnirea particulelor alfa este aproape unică, adică. fiecare particulă se ciocnește cu un singur atom, schimbându-și direcția zborului.
(e este valoarea sarcinii electrice elementare). Viteza particulei alfa a fost de ordinul 107 m/s, energia a fost de 4,05 MeV. Când grosimea foliei este mică, ciocnirea particulelor alfa este aproape unică, adică. fiecare particulă se ciocnește cu un singur atom, schimbându-și direcția zborului.
Pereții interiori ai ecranului au fost acoperiți cu fosfor, o substanță în care au apărut fulgerări acolo unde particulele alfa lovin. Acest lucru a făcut posibilă înregistrarea particulelor alfa cu dispozitivul M, împrăștiate de atomi la diferite unghiuri θ față de direcția inițială. Experimentele privind împrăștierea particulelor alfa au făcut posibilă stabilirea următoarelor modele.
1. Marea majoritate a particulelor alfa trec prin folie aproape liber: nu sunt deviate și nu pierd energie.
2. Doar o mică fracțiune de particule (≈ 0,01%, adică o zece miimi) s-a întors înapoi, adică a schimbat direcția de mișcare cu un unghi mai mare de 90 de grade.
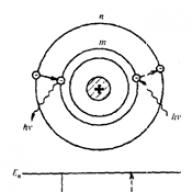
Rezultatele experimentelor lui Rutherford pot fi explicate pe baza presupunerii că toată sarcina pozitivă și aproape întreaga masă a atomului sunt concentrate într-o regiune mică a atomului - nucleul, ale cărui dimensiuni sunt de aproximativ 10 -14 m. Negativ electronii încărcați se mișcă în jurul nucleului într-o zonă uriașă (în comparație cu nucleul), a cărei dimensiune este de aproximativ 10 -10 m.
Această presupunere stă la baza modelul nuclear al atomului, care se mai numește și planetar. Numărul de electroni dintr-un atom este egal cu numărul atomic al elementului din tabelul periodic Mendeleev. În plus, s-a demonstrat că forțele care leagă electronii cu nucleul sunt supuse legii lui Coulomb.
Cu toate acestea, modelul nuclear contrazice legile electrodinamicii clasice. De fapt, dacă un electron este în repaus într-un atom, acesta trebuie să cadă pe nucleu sub influența forței de atracție Coulomb. Dacă un electron orbitează un nucleu, ar trebui să emită un câmp electromagnetic. În același timp, își pierde energia prin radiație, viteza de mișcare scade și electronul trebuie să cadă în cele din urmă pe nucleu. Spectrele de emisie ale atomilor în acest caz ar trebui să fie continue, iar durata de viață a unui atom nu trebuie să depășească 10 -7 s. De fapt, atomii sunt stabili, iar spectrele de emisie ale atomilor sunt discrete.
Lecție de fizică în clasa a XI-a
Subiect:
„Experimentul de împrăștiere a particulelor alfa al lui Rutherford”
Scopurile și obiectivele lecției:
Educational:
Explicați mecanismul experimentelor lui Rutherford
Educational:
dezvoltarea independenței cognitive a elevilor;
contribuie la educația lor morală și estetică.
Educational:
dezvolta capacitatea de a evidenția principalele, esențiale, de a compara faptele studiate și de a exprima logic gândurile.
În timpul orelor:
eu.Org. moment.
Stați drept lângă birou și curățați-vă. Salutați profesorul. Apoi stai linistit pe scaunul tau si mentine ordinea in sala de clasa.
Stabilirea temei și a scopului lecției.
II. Repetiţie
Spectre de linii
1. Ce înseamnă cuvântul atom?2.Care om de știință a descoperit legea repetării periodice a proprietăților elementelor chimice?
3.Este un atom indivizibil?
4.Ce se întâmplă cu gazele rarefiate când sunt încălzite la o temperatură ridicată?
5.Care sunt numele liniilor multicolore separate prin spații întunecate?
6.Ce este inerent fiecărui gaz?
7.Care gaz are cel mai simplu spectru?
8.Care spectru de gaze este format din 4 linii?
9.Care om de știință a selectat formula liniilor spectrale pentru regiunea vizibilă?
10. A cui teorie a făcut posibilă combinarea formulelor regiunilor vizibil, ultraviolet și infraroșu într-o singură formulă generală?
Fizminutka conform videoclipului.
III. Material nou
§ 7.2. Experimentul lui Rutherford privind împrăștierea particulelor alfa.
Studiind împrăștierea particulelor alfa pe măsură ce trec prin folia de aur,ErnestRutherford a ajuns la concluzia că toată sarcina pozitivă a atomilor este concentrată în centrul lor într-un nucleu foarte masiv și compact. Și particulele încărcate negativ (electroni) se rotesc în jurul acestui nucleu.

Acest model era fundamental diferit de modelul Thomson al atomului, care era larg răspândit la acea vreme.

Iosif IoanThomson a propus un model al atomului sub formă de budincă (plăcintă), în care o sarcină pozitivă a umplut uniform întregul volum al atomului, iar electronii au fost intercalate cu acesta.

Ceva mai târziu, modelul lui Rutherford a fost numit modelul planetar al atomului (este într-adevăr similar cu sistemul solar: nucleul greu este Soarele, iar electronii care se învârt în jurul lui sunt planetele).
În 1912, E. Rutherford și colaboratorii săi au efectuat un experiment privind împrăștierea particulelor alfa în materie.

Schema experimentelor lui Rutherford.
În absența foliei, pe ecran a apărut un cerc luminos, constând din scintilații cauzate de un fascicul subțire de particule alfa. Dar atunci când o folie subțire de aur cu o grosime de aproximativ 0,1 μm (micron) a fost plasată în calea particulelor alfa, imaginea observată pe ecran s-a schimbat foarte mult: blițurile individuale au apărut nu numai în afara cercului anterior, dar puteau chiar fi observată din partea opusă a foliei de aur.
Numărând numărul de scintilații pe unitatea de timp în diferite locuri de pe ecran, este posibil să se stabilească distribuția particulelor alfa împrăștiate în spațiu. Numărul de particule alfa scade rapid odată cu creșterea unghiului de împrăștiere.
Imaginea observată pe ecran a condus la concluzia că majoritatea particulelor alfa trec prin folia de aur fără o schimbare vizibilă a direcției de mișcare. Cu toate acestea, unele particule au deviat la unghiuri mari de la direcția inițială a particulelor alfa (aproximativ 135 o...150 o ) și chiar au fost aruncate înapoi. Studiile au arătat că, atunci când particulele alfa trec prin folie, pentru fiecare 10.000 de particule incidente, doar una este deviată cu un unghi mai mare de 10. O din direcția inițială de mișcare. Doar ca o excepție rară, una dintre numărul mare de particule alfa se abate de la direcția inițială.
Faptul că multe particule alfa au trecut prin folie fără a se abate de la direcția lor de mișcare sugerează că atomul nu este o entitate solidă. Deoarece masa unei particule alfa este de aproape 8000 de ori mai mare decât masa unui electron, electronii incluși în atomii foliei nu pot schimba în mod vizibil particulele alfa. Imprăștirea particulelor alfa poate fi cauzată de o particulă încărcată pozitiv a unui atom - nucleul atomic.
IV.Armare
Luarea în considerare a exemplelor.
V. Reflecţie
Ți-a plăcut lecția noastră de azi?.. Ce îți amintești?..
VI. D/Z repeta §7.1, invata §7.2
Ernest Rutherford este unul dintre fondatorii doctrinei fundamentale a structurii interne a atomului. Omul de știință s-a născut în Anglia, într-o familie de imigranți din Scoția. Rutherford a fost al patrulea copil din familia sa și s-a dovedit a fi cel mai talentat. El a reușit să aducă o contribuție deosebită la teoria structurii atomice.
Ideile inițiale despre structura atomului
Trebuie remarcat faptul că înainte de a fi efectuat faimosul experiment al lui Rutherford privind împrăștierea particulelor alfa, ideea dominantă la acea vreme despre structura atomului era modelul Thompson. Acest om de știință era sigur că sarcina pozitivă a umplut uniform întregul volum al atomului. Electronii încărcați negativ, credea Thompson, erau ca și cum ar fi intercalate cu ei.

Precondiții pentru o revoluție științifică
După absolvirea școlii, Rutherford, în calitate de cel mai talentat student, a primit o bursă de 50 de lire sterline pentru studii ulterioare. Datorită acestui fapt, a putut să meargă la facultate în Noua Zeelandă. În continuare, tânărul om de știință trece examenele de la Universitatea din Canterbury și începe să studieze serios fizica și chimia. În 1891, Rutherford a ținut primul său discurs despre „Evoluția elementelor”. Pentru prima dată în istorie, a subliniat ideea că atomii sunt structuri complexe.
La acea vreme, ideea lui Dalton că atomii erau indivizibili domina cercurile științifice. Pentru toată lumea din jurul lui Rutherford, ideea lui părea complet nebună. Tânărul om de știință a trebuit să-și ceară în mod constant scuze colegilor săi pentru „prostiile” lui. Dar după 12 ani, Rutherford a reușit totuși să demonstreze că are dreptate. Rutherford a avut șansa să-și continue cercetările la Laboratorul Cavendish din Anglia, unde a început să studieze procesele de ionizare a aerului. Prima descoperire a lui Rutherford au fost razele alfa și beta.

experiența lui Rutherford
Descoperirea poate fi descrisă pe scurt după cum urmează: în 1912, Rutherford, împreună cu asistenții săi, au efectuat faimosul său experiment - particulele alfa au fost emise dintr-o sursă de plumb. Toate particulele, cu excepția celor care au fost absorbite de plumb, s-au deplasat de-a lungul canalului instalat. Fluxul lor îngust a căzut pe un strat subțire de folie. Această linie era perpendiculară pe foaie. Experimentul lui Rutherford privind împrăștierea particulelor alfa a demonstrat că acele particule care au trecut chiar printr-o folie de folie au provocat așa-numitele scintilații pe ecran.
Acest ecran a fost acoperit cu o substanță specială care a început să strălucească atunci când particulele alfa îl loveau. Spațiul dintre stratul de folie de aur și ecran a fost umplut cu un vid pentru a preveni împrăștierea particulelor alfa în aer. Un astfel de dispozitiv a permis cercetătorilor să observe particulele care se împrăștie la un unghi de aproximativ 150°.
Dacă folia nu a fost folosită ca obstacol în fața fasciculului de particule alfa, atunci pe ecran sa format un cerc ușor de scintilații. Dar de îndată ce o barieră de folie de aur a fost pusă în fața grinzii lor, imaginea s-a schimbat foarte mult. Flash-urile au apărut nu numai în afara acestui cerc, ci și pe partea opusă a foliei. Experimentul lui Rutherford privind împrăștierea particulelor alfa a arătat că majoritatea particulelor au trecut prin folie fără modificări vizibile în traiectoria lor.
În acest caz, unele particule au fost deviate la un unghi destul de mare și chiar au fost aruncate înapoi. Pentru fiecare 10.000 de particule care treceau liber printr-un strat de folie de aur, doar una a fost deviată cu un unghi care depășește 10° - ca excepție, una dintre particule a fost deviată de un astfel de unghi.

Motivul pentru care particulele alfa au fost deviate
Ceea ce experimentul lui Rutherford a examinat și a dovedit în detaliu este structura atomului. Această situație a indicat că atomul nu este o formațiune continuă. Majoritatea particulelor au trecut liber prin folia cu grosimea unui atom. Și deoarece masa unei particule alfa este de aproape 8.000 de ori mai mare decât masa unui electron, acesta din urmă nu ar putea afecta semnificativ traiectoria particulei alfa. Acest lucru ar putea fi făcut numai de nucleul atomic - un corp de dimensiuni mici, care posedă aproape toată masa și toată sarcina electrică a atomului. În acel moment, aceasta a devenit o descoperire semnificativă pentru fizicianul englez. Experiența lui Rutherford este considerată unul dintre cei mai importanți pași în dezvoltarea științei structurii interne a atomului.
Alte descoperiri făcute în procesul studierii atomului
Aceste studii au oferit dovezi directe că sarcina pozitivă a unui atom este situată în interiorul nucleului său. Această zonă ocupă un spațiu foarte mic în comparație cu dimensiunile sale totale. Într-un volum atât de mic, împrăștierea particulelor alfa sa dovedit a fi foarte puțin probabilă. Și acele particule care au trecut în apropierea regiunii nucleului atomic au experimentat abateri puternice de la traiectorie, deoarece forțele de respingere dintre particula alfa și nucleul atomic erau foarte puternice. Experimentul lui Rutherford de împrăștiere a particulelor alfa a demonstrat probabilitatea ca o particule alfa să lovească direct nucleul. Adevărat, probabilitatea a fost foarte mică, dar tot nu zero.
Acesta nu a fost singurul fapt pe care l-a dovedit experiența lui Rutherford. Structura atomului a fost studiată pe scurt de colegii săi, care au făcut o serie de alte descoperiri importante. Cu excepția învățăturii că particulele alfa sunt nuclee de heliu cu mișcare rapidă.
Omul de știință a reușit să descrie structura unui atom în care nucleul ocupă o mică parte din volumul total. Experimentele sale au demonstrat că aproape întreaga sarcină a unui atom este concentrată în nucleul său. În acest caz, apar atât cazurile de deviere a particulelor alfa, cât și cazurile de ciocnire a acestora cu nucleul.

Experimentele lui Rutherford: modelul nuclear al atomului
În 1911, Rutherford, după numeroase studii, a propus un model al structurii atomului, pe care l-a numit planetar. Conform acestui model, în interiorul atomului există un nucleu care conține aproape întreaga masă a particulei. Electronii se mișcă în jurul nucleului într-un mod similar cu modul în care planetele se mișcă în jurul Soarelui. Din combinația lor se formează un așa-numit nor de electroni. Atomul are o sarcină neutră, așa cum a arătat experimentul lui Rutherford.
Structura atomului a devenit mai târziu de interes pentru un om de știință pe nume Niels Bohr. El a fost cel care a finalizat învățătura lui Rutherford, deoarece înainte de Bohr modelul planetar al atomului a început să întâmpine dificultăți de explicație. Deoarece electronul se mișcă în jurul nucleului pe o anumită orbită cu accelerație, mai devreme sau mai târziu trebuie să cadă pe nucleul atomului. Cu toate acestea, Niels Bohr a reușit să demonstreze că în interiorul atomului legile mecanicii clasice nu se mai aplică.
Concluzii din experimentul lui Rutherford de împrăștiere a particulelor alfa: 1. Există un nucleu atomic, i.e. un corp mic în care se concentrează aproape întreaga masă a unui atom și toată sarcina pozitivă. 2. Aproape întreaga masă a atomului este concentrată în nucleu. 3. Particulele negative - electroni - se rotesc în jurul nucleului pe orbite închise. 4. Sarcina negativă a tuturor electronilor este distribuită pe întregul volum al atomului. Modelul nuclear al unui atom:
Slide 9 din prezentare „Experimentul lui Rutherford, modelul atomului”. Dimensiunea arhivei cu prezentarea este de 174 KB.Fizica clasa a IX-a
rezumatul altor prezentări„Structura atomului unui element” - Cine a descoperit fenomenul radioactivității. Structura. Atomul este „indivizibil”. Rutherford a efectuat o serie de experimente pentru a studia structura și compoziția atomilor. Thomson a propus unul dintre primele modele ale structurii atomului în 1903. Henri Becquerel descoperă fenomenul radioactivității. Particula a provocat un fulger pe ecran. Două evenimente de la sfârșitul secolului al XIX-lea au condus la ideea unei structuri atomice complexe. Structura atomului. Model planetar (nuclear).
„Cameră în nor” - Scopul dispozitivului. Principiul robotului. Îmbunătăţire. Capacitate. Inventatorul dispozitivului. Sens. Aparat foto. Wilson. Camera Wilson. Dispozitiv.
„Siguranța energiei nucleare” - Din istoria energiei nucleare. Reacția de descompunere a nucleelor de uraniu. Diagrama de funcționare a unui reactor nuclear în fierbere. Siguranță. Diagrama unui reactor nuclear în fierbere. Centralele nucleare au mai multe capacități în producția de energie. Centrale nucleare. Daunele energiei nucleare. Centralele nucleare pe harta Rusiei. Reactor nuclear. Energie nucleara. Fuziunea termonucleară. Beneficiile și daunele energiei nucleare. Spărgătoare de gheață nucleare.
„Fizica „Mișcare”” - Interacțiunea corpurilor. Mecanica. Legea conservării în mecanică. Structura atomului. Inerția și masa corpurilor. Viteză în timpul mișcării inegale. Cum se schimbă coordonatele. Mișcarea în timpul mișcării rectilinie uniform accelerate. Bazele dinamicii. Munca de forta. Legea a 2-a a lui Newton. Căderea liberă a corpurilor. Fundamentele fizicii. Studierea proprietăților materiei. Vector. a 3-a lege a lui Newton. Perioada și frecvența circulației. Accelerare. Fizica este o știință exactă.
„Oscilațiile unui pendul matematic” - Planul de lecție. Utilizarea practică a oscilațiilor pendulului. Galileo Galilei (1564-1642). Huygens Christian (1629 – 1695). Orice corp poate efectua mișcări oscilatorii. Experimentul a fost efectuat într-un cerc îngust. Ilustrarea vibrațiilor mecanice folosind exemplul unui pendul Foucault. Clădirea veche a Universității din Pisa. Un pendul adevărat poate fi considerat matematic dacă lungimea firului este mult mai mare decât dimensiunea corpului suspendat pe el.
„Prima viteză cosmică” - Rezolvați probleme. Accelerarea căderii libere. Viteza care trebuie transmisă unui corp pentru ca acesta să devină satelit. Introducere în sateliții artificiali. Prima viteză de evacuare. Condiții în care un corp devine inteligență artificială. Sateliți artificiali ai Pământului. Determinați prima viteză de evacuare pentru lansarea satelitului. Rezolva problema. Revoluția planetelor în jurul Soarelui.