Infecția reovirală a găinilor (tenosinovina virală a găinilor, tenosinovita reoviral) este o boală contagioasă virală a păsărilor, caracterizată prin diaree, tenosinovită și artrită.
Etiologie. Agentul cauzal al bolii este un virus care conține ARN din familia Reoviridae. Virusul este capabil să persistă mult timp într-un organism infectat. Cultivat în embrioni de pui. Și în cultura celulară a rinichilor găinilor cu formarea de synthia.
Epizootologia. Găinile și găinile se îmbolnăvesc. Sursa de infecție este o pasăre purtătoare de virus bolnavă și recuperată (purtător de virus continuă 289 de zile). Infecția are loc pe cale alimentară, precum și transovarian. Transmiterea virusului are loc printr-un ou incubat obținut atât de la păsări bolnave, cât și de la păsări în curs de recuperare. Factorii de transmitere ai agentului patogen sunt excrementele infectate, apa, furajele, inventarul și articolele de îngrijire. Mortalitatea poate ajunge la 30% cu o incidență de 100%.
Patogeneza. Virusul se înmulțește în celulele epiteliale ale intestinului, provocând dezvoltarea enteritei catarale, peritonitei gălbenușului. Ulterior, apare atrofia ovariană și formarea foliculilor limfoizi în tendoane.
Simptome și curs. Perioada de incubatie este de 2-7 zile.Boala este acuta la pui si cronic la puii adulti. Infecția este însoțită de blocarea cloacii, o scădere a productivității cărnii. Reovirusurile pot provoca diaree, deshidratare, anemie, penaj slab și alte simptome.
Puii de vită, de obicei în vârstă de 5 săptămâni, și găinile de ouă între 9 și 10 luni, dezvoltă tumori bilaterale ale tendonului flexor al gleznei. Pasărea începe să șchiopătească, găinile și găinile se mișcă cu mare dificultate. Cu o boală de lungă durată, trecând de la o formă acută la una cronică, se observă o ruptură a tendoanelor gleznei. Artrita se dezvoltă adesea.
modificări patologice. Când o pasăre moartă este deschisă, se dezvăluie prezența tenosinovitei, artritei, enteritei catarhal-ulcerative, rinitei catarală, laringitei și a fenomenului de anemie generală.
Caracterizarea reovirusurilor aviare
Reovirusuri aviare: genul Orthoreoviruses ( Ortoreovirus) sunt virusuri neîncapsulate care conțin ARN aparținând familiei Reoviridae. Virionul are o dimensiune de 70-80 nm, formă icosaedrică. Genomul ARN cu dublu helix conține 10-12 segmente. Genomul codifică opt proteine structurale (λA, λB, λC, μA, μB, σA, σB, σC) și patru proteine nestructurale (μNS, P10, P17, σNS). Locul de replicare principală a reovirusurilor aviare este celulele epiteliale ale intestinului subțire și bursa lui Fabricius, de unde virusul se răspândește la toate organele și țesuturile în 24-48 de ore după infectare. Reovirusurile provoacă un număr mare de boli la păsările de diferite specii. La pui și curcani, infecția cu reovirus apare odată cu dezvoltarea artritei/tenosinovitei. La pui, se remarcă și dezvoltarea miocarditei, pancreatitei, heptitei și enteritei. La papagali și gâște, infecția cu reovirus provoacă hepatită necrozantă și splenită.
Reovirusurile au fost izolate de la păsările sănătoase și bolnave, adesea infecția apare cu un număr mare de alte boli secundare, ceea ce necesită o analiză amănunțită a semnificației clinice a fiecărei infecții detectate.
Caracteristici ale cursului infecției la corvide
Reovirusurile (Avian reovirus ARV) sunt agenți frecventi cauzatori ai bolilor corvidelor, care apar cu mortalitate ridicată. Infecție raportată în America de Nord la corbii americani Corvus brachyrhynchos(SUA, Canada); în Europa - la cioara gri Corvus corona cornix(Finlanda), corb negru corvus corone(Belgia), ghiocă comună Corvus monedula(Polonia). Pentru dreptate, trebuie spus că în Europa și țările CSI nu există o monitorizare activă a bolilor păsărilor sălbatice, așa cum se face în America de Nord, prin urmare, există foarte puține date reale privind răspândirea epizootiilor reovirusurilor în rândul corvidelor în Europa și, în special, în Rusia...
Corvidele sunt foarte sensibile la Virusul West Nile (WNV), astfel încât în Europa și America de Nord, corvidele sălbatice servesc drept „indicatori naturali” ai dezvoltării epidemilor cauzate de flavivirusuri ( Flaviviridae); în cursul studiilor epizootiilor cauzate de virusul West Nile, cercetătorii au descoperit că simptomele neurologice similare (incapacitatea de a zbura, convulsii, torticolis, lipsa de răspuns la apropierea unei persoane și a animalelor domestice) la corvide sunt, de asemenea, cauzate de reovirus, la care corvidele s-au dovedit a fi foarte sensibili. Astfel, studiul unui virus a descoperit o boală necunoscută anterior la corvidele sălbatice.
Reovirus la magpie comună
Mai jos este o descriere detaliată a examinării magpiei comune moarte ( pica pica) în Anglia, unde a fost detectată o infecție cu reovirus.
Starea unei păsări bolnave
Magpie (femela adultă) a fost găsită pe moarte fără semne specifice. Pasărea a murit la scurt timp după ce a fost ridicată de rehabilitatori. Patkartina la autopsie a fost după cum urmează: epuizare - reducerea semnificativă a masei musculare pectorale, lipsa grăsimii subcutanate; pielea este strâns legată de țesutul subcutanat - semn de deshidratare. Coada și penele de zbor sunt în stare proastă, cu mulți țepi rupti și multe linii de stres indicând o evoluție cronică a bolii.
Semne anatomice patologice (patkartina)
Ficat: mărit semnificativ (hepatomegalie), cu margini rotunjite, parenchim portocaliu cu leziuni miliare incolore. Splina este mărită (splenomegalie), cu focare multiple de hemoragie. Bursa lui Fabricius nu a fost găsită. Plămânii sunt umpluți bilateral cu sânge. Sacii de aer și pericardul sunt galben deschis, ușor îngroșate și opace. În cavitatea bucală, un focar extins de culoare crem deschisă, consistență lejeră, atașat de mucoasa palatului și extinzându-se până la fundul cavității bucale în jurul limbii. Stomacul glandular și muscular este gol. O cantitate moderată de chim lichid, pătat cu sânge, a fost găsită în intestinul subțire, vasele mezenterului erau puternic umplute cu sânge. Intestinul gros conține o cantitate moderată de material pastos maro închis. Glandele suprarenale sunt mărite și bine vizibile. Vasele creierului sunt pline cu sânge.
Ficatul unei magpie care a murit din cauza unei infecții reovirale la o autopsie. Tabloul anatomic patologic al hepatomegaliei, modificări ale culorii ficatului, focare miliare de necroză. Inima: hidropericardită.
Analiza bacteriologică
În timpul analizei bacteriologice a ficatului, conținutului intestinal și impunerea din cavitatea bucală, s-a izolat o cultură pură din țesuturile ficatului și conținutului intestinal. Culturile într-un mediu anaerob nu au evidențiat semne de clostridii ( Clostridium spp.). Colorația Ziehl-Neelsen a frotiurilor hepatice nu a evidențiat organisme acido-resistente.
Analiza histologică
Bucățile de organe interne au fost introduse într-o soluție tamponată de formol neutră 10%, după care s-au făcut preparate histologice conform schemei standard. Pe lângă colorarea standard a preparatelor histologice cu Hematoxilin-Eozină, preparatele tisulare au fost colorate suplimentar conform Giemsa, Gram, Albastru Prusia Perls, Schiff (Acid Periodic-Schiff) și Ziehl-Neelsen.
Analiza histologică a evidențiat zone extinse de hepatită acută necrozantă confluentă asociată cu depunerea de hemosiderin (detectată prin colorarea albastrului de Prusia Perls). Zonele de necroză hepatică au fost destul de masive (ceea ce ar putea duce la moartea păsării din cauza insuficienței hepatice). S-a găsit și colangită focală moderată cauzată de blocarea căilor biliare de către trematode. Splina: confluent, necroză focală acută a pulpei, edem, focare de hemoragii în parenchim, atrofie limfoidă difuză. Suprarenale: hiperplazie corticală difuză. Nu au fost găsite leziuni în țesuturile creierului.

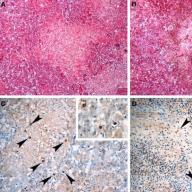
Prepararea histologică a țesuturilor hepatice și splinei unei magpie care a murit din cauza unei infecții cu reovirus. A. Focalizarea necrozei acute confluente a hepatocitelor. Colorație cu hematoxilină-eozină. Mărire 200. B. Necroza fibrinoasă a splinei. Colorație cu hematoxilină-eozină. Mărire 200.
CD. Demonstrarea ARN-ului reovirus aviar în timpul hibridizării in situ în celule (săgeți) din leziuni ale ficatului (C) și splinei (D).
Sursa: Lawson B., Dastjerdi A., Shah S., Everest D., Núñez A., Pocknell A., Hicks D., Horton D.L., Cunningham A.A., Irvine R.M.: Mortality associated with avian reovirus infection in a free-living magpie (Pica pica) în Marea Britanie. BMC Vet Res 2015, 11, 20, doi: 10.1186/s12917-015-0329-5
Teste virologice
Țesuturile creierului și rinichilor de magpie au fost examinate prin PCR utilizând primeri pentru virusul West Nile și primeri comuni pentru flavivirusuri. Rezultatele au fost negative. Țesuturile rinichilor și splinei au fost examinate prin PCR pentru prezența materialelor genetice comune virusurilor herpetice - rezultatul a fost negativ.
Omogenatul țesutului hepatic și conținutul intestinului subțire a fost examinat cu ajutorul microscopiei electronice cu contrast negativ, care a evidențiat prezența particulelor virale cu dimensiunea de 77-78 nm; forma virionilor din ambele probe corespundea reovirusurilor.

Micrografie electronică transmisibilă a unui reovirus izolat din țesuturile hepatice de magpie în timpul cultivării. Dună 100 nm.
Sursa: Lawson B., Dastjerdi A., Shah S., Everest D., Núñez A., Pocknell A., Hicks D., Horton D.L., Cunningham A.A., Irvine R.M.: Mortality associated with avian reovirus infection in a free-living magpie (Pica pica) în Marea Britanie. BMC Vet Res 2015, 11, 20, doi: 10.1186/s12917-015-0329-5
Diagnosticare moleculară
După aceea, analiza PCR a țesuturilor hepatice și splinei a fost efectuată cu primeri ai segmentului L2 al genomului comun reovirusurilor. Răspunsul la gena L2 a reovirusurilor (ARN polimerază dependentă de ARN - aproximativ 274 de baze) a fost pozitiv.
De asemenea, virusul a fost izolat din țesuturile ficatului, rinichii, conținutul intestinului subțire în cultura celulară. În ambele cazuri (material din rinichi/ficat și conținutul intestinului subțire), a fost detectat un efect citopatic. Microscopia electronică a culturilor de țesuturi a evidențiat particule virale similare cu cele găsite în țesuturile hepatice native și în conținutul intestinului subțire.
Folosind hibridizarea in situ, a fost efectuat un studiu imunohistochimic al țesuturilor hepatice și splinei, care a evidențiat o acumulare predominantă de particule virale în zonele de necroză și parenchim adiacent (vezi fotografia specimenului histologic).
Arborele filogenetic al virusului, construit pe baza analizei a 285 de aminoacizi ai proteinei C, a arătat că virusul izolat din magpie era aproape de reovirusul de pui izolat în India, SUA și China și destul de departe de reovirusuri de pui izolate în Europa continentală.
Infecții secundare și concluzie
Ficatul și splina acestei magpie au fost afectate în același mod ca cele descrise pentru papagalii cu infecție cu reovirus. Splenita necrozantă este adesea descrisă la corbii cu reovirus. La corvide sunt descrise adesea simptome neurologice; această navă nu a putut zbura când a fost găsită, dar nu au fost găsite semne de deteriorare a sistemului nervos central, cu excepția vaselor pline de sânge ale creierului. Descoperit. Depleția limfoidă și, ca urmare, imunosupresia și dezvoltarea bolilor bacteriene și fungice secundare la păsări sunt, de asemenea, semne frecvent descrise ale infecției cu reovirus. Deoarece examenul histologic nu a evidențiat colonii bacteriene diseminate sau un proces inflamator pronunțat, înseamnă că izolarea E. coli din diverse organe și conținut intestinal indică cel mai probabil o invazie bacteriană post-mortem, mai degrabă decât o infecție sistemică diseminată.
Apropierea genomului reovirusului izolat de la magpie de reovirusurile de pui din America de Nord, India, Israel și China, dar nu și de genomul reovirusurilor izolate de la pui din Europa de Nord-Vest, rămâne neclară. Acest lucru sugerează, de asemenea, că corvidele sălbatice se pot infecta de la păsările crescute industrial în fermele de păsări.
Moartea corbilor americani ( Corvus brachyrhynchos) de la infecția cu reovirus în Canada
Infecția a decurs rapid, majoritatea păsărilor moarte au fost bine hrănite fără niciun semn de epuizare. Cel mai vizibil semn patoanatomic a fost inflamația hemoragică a intestinului subțire. La unii corbi morți s-a găsit splenită concomitentă cu focare de necroză parenchimoasă.
Păsările au fost testate pentru virusul West Nile, un ucigaș comun al corvidelor în America de Nord, și pentru gripa aviară, toate fiind negative. Analizele bacteriologice nu au evidențiat niciun agent infecțios la corbii morți. La autopsie nu au existat semne de otrăvire.
Testele tisulare ale ficatului, splinei, rinichilor și intestinelor au fost toate pozitive pentru infecția cu reovirus. Ce fel de analize s-au făcut nu este specificat în notă.
Din 2000, conform Centrului Național de Sănătate a Faunei Sălbatice (NWHC USGS Madison Wi.), moartea corbilor americani din cauza reovirusului a fost observată în diferite părți ale Statelor Unite.

Enterita hemoragică la un corb american ( Corvus brachyrhynchos) care a murit în urma reconstrucției unei infecții cu reovirus.
Boala curcanilor (pieptene albastru, enterita infectioasa, enterita transmisibila, enteronefrita reovirala), gainilor si gainilor (tenosinovita, artrita virala, "indigestie la hrana" si sindromul "pasarii palide"), ratuste si gaste, manifestata printr-un complex de simptome divers si determinand daune economice semnificative.
Reovirusurile aviare sunt rezistente la lumina ultravioletă, nu sunt inactivate într-un interval larg de pH și sunt relativ insensibile la dezinfectanții convenționali. Vaporii de formaldehidă nu o neutralizează pe suprafața cochiliei ouălor pentru incubație; puii se pot infecta cu virus atunci când ciugulesc trapa.
Reovirusurile se înmulțesc bine pe embrionii de pui și curcan, cultura de celule fibroblaste de pui sau cultura de celule de rinichi aviar. În condiții naturale, anticorpii împotriva infecției cu reovirus au fost detectați la păsările de curte din diferite țări.
Principala sursă de infecție este o pasăre bolnavă, excrețiile sale. Fiind în fecale, virusul intră în mediul înconjurător și infectează alimentele și apa.
Tabloul clinic
În a 5-a zi, animalele tinere bolnave au diaree, depresie și mortalitate de până la 5% sau mai mult. Curcanii și gâsarii supraviețuitori pot dezvolta sinuzită infraorbitară, conjunctivită. Boala devine cronică, creșterea tânără rămâne în urmă în dezvoltare. Până la vârsta de trei săptămâni, puii dezvoltă tenosinovită, în care există o setare incorectă a picioarelor, șchiopătură. În grupul nefavorabil pentru infecția cu reovirus, diversitatea în dezvoltarea animalelor tinere este pronunțată, un semn frecvent este „uscarea” carcasei din cauza palatabilității și digestibilității reduse a furajelor.
Când o pasăre este infectată cu un reovirus în 10-30 de zile, boala este mai puțin acută, deșeurile nu depășesc 1,5-5%, cu toate acestea, productivitatea planificată de la o astfel de pasăre nu se obține.
Cea mai semnificativă pierdere în cursul acut al infecției cu reovirus se observă la păsările tinere producătoare de carne: 5-18% la puii de carne, 50% la curcani și găsari și până la 100% la rățui.
În cursul natural al infecției, se observă edem ale tecilor tendonului și hemoragii în ele, în cavitatea articulațiilor afectate. În cursul cronic al bolii, se evidențiază îngroșarea tecii tendonului, deshidratarea, anchiloza articulației, sunt posibile rupturi ale tendonului atrofiat.
Patomorfologie
Într-un curs necomplicat al bolii, enterita catarrală, o creștere a rinichilor sunt caracteristice. Mușchii sunt deshidratați, în stare de distrofie.
Diagnosticare
Diagnosticul se bazează pe date epidemiologice, semne clinice, modificări anatomopatologice și rezultate de laborator. Pentru diagnosticarea de laborator se folosesc RN, RSK, DP, ELISA. O turmă este considerată nefavorabilă pentru infecția cu reovirus, unde titrurile de anticorpi în pH depășesc o diluție de 1:40.
Artrita reovirală trebuie diferențiată de bronșita infecțioasă, EDS-76 și micoplasmoza respiratorie. Cu aceste boli, nu există îngroșarea tendoanelor.
Tratament și prevenire
Una dintre principalele condiții pentru lupta împotriva infecției cu reovirus a păsărilor este prevenirea introducerii infecției din fermele care sunt nefavorabile pentru această boală. Depunerea ouălor pentru incubație trebuie efectuată numai după dezinfecția umedă a acestora. După dezinfecția umedă, ouăle sunt uscate și incubate într-un incubator pregătit cu grijă.
 |
|
| Artrita virală: afectarea ficatului |
Dacă se suspectează o infecție cu reovirus, pentru a crește rezistența generală, se îmbunătățește hrănirea întregului șeptel, se administrează vitamine în doze antistres. Cu 2-3 grade, cresc temperatura standard în cameră, îmbunătățesc schimbul de aer. Antibioticele cu spectru larg sunt introduse în dietă timp de 3-4 zile. Este important să se creeze un statut antioxidant ridicat în organismul păsării, deoarece contribuie la rezistența organismului la reovirusuri și la dezvoltarea infecției. În acest scop, se recomandă utilizarea selenitului de sodiu în dietă în doză de cel puțin 1 g pe tonă de furaj, vitamina E - 20-40 g pe tonă de furaj, precum și santochin - 200 g / t, ca precum și acid ascorbic - 50 g / t.
Într-o turmă disfuncțională, tratamentul se efectuează conform indicațiilor pentru a exclude apariția infecțiilor complicate și pentru a crește rezistența păsării. În încăperile în care sunt izolate păsările bolnave, dezinfecția cu aerosoli se efectuează cu o soluție de trietilen glicol în conformitate cu instrucțiunile actuale.
Pentru prevenirea specifică a acestei infecții se folosesc vaccinuri vii și inactivate.
Infecția cu reovirus a păsărilor (tenosinovită, artrită virală, slăbiciune a picioarelor, proventriculită reovirală, „absorbție slabă”, „pasăre palidă”, „cloacae lipită”, monocitoză de puieți etc.) a fost înregistrată în toate țările lumii și a fost înregistrată. curent persistent subacut, cronic sau latent, este larg răspândit în rândul găinilor, curcanilor, gâștelor și păsărilor sinantropice.
Tenosinovita este o boală reovirus contagioasă. Se caracterizează prin șchiopătare asociată cu inflamația flexorului digital, a tendoanelor extensorii tarsului și a bursei. În curs cronic, este însoțită de ruptura tendonului și eroziunea cartilajului articular.
Virusul a fost izolat pentru prima dată în Statele Unite în 1968 la puii de carne, iar în 1974 și 1975 au fost identificate avireovirusuri la curcani și gâște din țara noastră. Au fost izolate tulpini epizootice ale agentului patogen de la pui și curcani, s-au studiat proprietățile fizico-chimice ale acestora, s-au propus metode (RDP și RNHA) de diagnosticare a bolii.
Cu toate acestea, din cauza manifestărilor clinice foarte diverse ale bolii, a complexității interpretării modificărilor observate în timpul examinării post-mortem, precum și a dificultăților de a dovedi rolul etiologic al avireovirusurilor, aceste boli aviare rămân slab înțelese până în prezent.
Agentul cauzal al bolii este un reovirus care conține ARN cu un diametru de particule de 75-76 nm. Este rezistent la căldură și rezistă la temperaturi de 60°C timp de 8-10 ore, 56°C până la 22-24 ore, 37°C până la 15-16 săptămâni, 22°C până la 48-61 săptămâni , 4°C până la 3 ani, — 20°C mai mult de 4 ani, rezistent la eter, cloroform, radiații UV și își păstrează activitatea după dezinfecția cu vapori de formaldehidă. Virusul este inactivat cu hidroxid de sodiu 3%, etanol 70%, compuși organici cu iod 0,5%, estosteril 0,1% timp de 3 minute la +20°C și formalină 3% la +56°C timp de 30 de minute.
Boala provoacă moartea păsărilor în 5-30% din cazuri, reduce eclozabilitatea, provoacă piperizarea găinilor, duce la sacrificarea de la 2 până la 15% din păsări și are un efect imunosupresor.
Factorii predispozanți ai bolii includ: încălcarea tehnologiei de creștere a păsărilor (supracompactare, hipotermie, transplant), creșterea acidității furajelor, hrănirea dezechilibrată în ceea ce privește proteinele, carbohidrații, vitaminele, macro și microelemente.
Semnele clinice și modificările patologice depind de virulența și doza agentului patogen, de metodele de aplicare a acestuia și de rezistența păsării. Perioada de incubație durează de la 5 la 13 zile. La 5-10% dintre păsări, se observă șchiopătură de diferite grade, umflarea articulației jaretului unuia sau ambelor picioare, mers înclinat, răsucirea degetelor, din cauza rupturii tendonului. Tendoanele afectate devin mai dense, se întăresc, se slăbesc, se lipesc de piele.
La puii de carne, până la 30% dintre păsări au pipernicie, 5-18% dintre ele mor, până la vârsta de 3 săptămâni păsările au nanism, pene slabe și diaree. Când se deschid puii de carne morți, se observă enterită catarrală, rinichi măriți, proventriculită, stomac muscular subțiere.
Pentru o pasăre adultă, un curs cronic sau latent-persistent al bolii este mai caracteristic. În acest caz, producția lor de ouă scade, 20-30% dintre păsări sunt epuizate, 5-10% dintre indivizi sunt sacrificați, 1-2% dintre păsări mor. La autopsie, se înregistrează edem al tecilor tendoanelor, îngroșarea și ruptura tendoanelor, anchiloza articulațiilor, enterita catarală, creșterea bruscă a rinichilor, hiperemia pancreasului și flacidența mușchiului inimii.
O analiză a situației epizootice cu teposipovit reoviral la pui în Federația Rusă în ultimul deceniu indică o răspândire largă a bolii. Prin metoda ELISA, MFA, studii virologice și patomorfologice, persistența agentului patogen a fost stabilită în 90-95% din fermele de păsări cercetate, specializate în cruce Loman Brown și păsări de carne. A fost dezvăluită o gamă largă de patogenitate a izolatelor virale care circulă în țară.
În procesul de studiu a bolii, oamenii de știință VNVIP au stabilit caracteristici epizootologice la pui. Deci, de exemplu, este evident că sursa de infecție este o pasăre bolnavă și moartă, purtători latenți de virus, ouă pentru incubație și deșeuri de incubație, furaje contaminate cu un agent patogen, echipamente tehnologice infectate; transmiterea virusului are loc prin contact, mijloace aerogenice sau alimentare; agentul patogen se caracterizează prin contagiozitate ridicată, persistă în corpul unei păsări; cei mai sensibili la boală sunt puii de găină cu vârsta cuprinsă între 1 și 6 zile; factorii de stres sunt importanți.
Tenosinovita reovirală apare adesea în asociere cu boli bacteriene sau alte boli virale.
Oamenii de știință de la VNIVIP au dezvoltat și introdus în practica creșterii industriale a păsărilor de curte un kit de diagnostic imunoenzimatic pentru tenosinovita reovirală la pui pentru a detecta anticorpi specifici în serul sanguin al păsărilor și pentru a evalua imunitatea post-vaccinare împotriva acestei boli. Diagnosticum are sensibilitate și specificitate ridicate, este ușor de configurat, vă permite să automatizați procesul de cercetare, nu este inferior celor mai bune sisteme de testare ale companiilor străine.
Specialiștii Institutului prin metoda trecerilor intermitente pe embrioni de pui și culturi celulare au atenuat tulpina „VNI-VIP-DEP”, care conform principalilor markeri genetici corespunde tulpinilor de referință de reovirus aviar. Pe baza tulpinii, a fost dezvoltată și stăpânită tehnologia de fabricare a vaccinului viral „TENOVAC”. Vaccinul este recomandat pentru producția de masă și utilizarea în creșterea păsărilor de curte pentru prevenirea specifică a tenosinovitei reovirale la pui; au fost primite un brevet de invenție și un certificat de marcă înregistrată. A fost elaborată o schemă pentru utilizarea vaccinului în scopuri preventive - recuperarea fermelor de această boală. Din 1997 până în 2000, au fost fabricate 10 loturi pilot de vaccin în valoare de 20 de milioane de doze, care au fost utilizate la fermele de păsări: Glazovskaya, Varaksinskaya, Botkinskaya, Uvinskaya (Udmurtia), Okinskaya (regiunea Irkutsk). .), „Zaozerskaya ", "Lebedevskaya" (regiunea Novosibirsk), teritoriile Krasnodar și Krasnoyarsk și regiunea Rostov.
Angajații Departamentului de Virologie și Boli Tumorale ale Păsărilor din VNIVIP, format din Academician al Academiei Ruse de Științe Agricole Korovin R.N., Doctor în Științe Veterinare Trefilov B.B., Candidații Spider Nikitina N.V. și Yavdoshak L.M. au primit o diplomă de diplomă de Academia Rusă de Științe Agricole „Pentru cea mai bună dezvoltare științifică a anului.
Aliev A.S., Profesor, Dr. Vet. Științe
Academia de Stat de Medicină Veterinară din Sankt Petersburg
Alieva A.K., asistent, dr. biol. Științe
Universitatea Pedagogică de Stat Rusă. A.ȘI. Herzen
Rezumat: Lucrarea realizează o trecere în revistă a virușilor, care provoacă adesea pauze de gastroenterită la efectivele comerciale de păsări. Astfel de cunoștințe sunt necesare pentru diagnosticarea bolilor gastrointestinale, care pot afecta grav economia industriei.
Adnotare: Articolul este o prezentare generală a virusurilor care provoacă cel mai frecvent focare de gastroenterită la păsările industriale. Aceste cunoștințe sunt necesare pentru diagnosticarea bolilor gastrointestinale care provoacă daune economice grave industriei avicole.
Cuvinte cheie: pui, curcani, boli gastrointestinale, infectie, diagnosticare, virusuri, patogeneza.
Bolile gastrointestinale de etiologie virală se găsesc la pui și curcani de toate grupele de vârstă, dar animalele tinere sunt predominant bolnave. Semnele clinice ale acestor infecții variază foarte mult, de la cele inaparente care provoacă pagube economice reduse până la forme severe care duc la pierderi economice majore. Rezultatul acestor boli infecțioase depinde de diverși factori interdependenți, cum ar fi virulența agentului patogen, vârsta și rezistența păsării infectate. În condiții naturale, aceste infecții sunt aproape întotdeauna complicate de alți agenți infecțioși. În plus, cursul lor depinde de condițiile de detenție, de hrănire și de diverși factori de mediu. În condiții de producție, este destul de dificil să se evalueze rolul etiologic al acestor agenți în patogeneza apariției unei anumite boli la păsări.
Pentru a dezvolta metode de diagnosticare a bolilor păsărilor de curte care provoacă tulburări ale tractului gastrointestinal, este necesară cunoașterea biologiei virusurilor, a patogenezei bolilor și a caracteristicilor epizootologice ale manifestării lor.
Până în prezent, microscopia electronică (EM) a fost folosită pentru a identifica multe virusuri asociate cu boli gastrointestinale la păsările de curte. Cu toate acestea, o caracterizare detaliată a virusurilor izolate și o evaluare a rolului lor în dezvoltarea infecției reprezintă o problemă serioasă, deoarece o parte semnificativă a virusurilor este dificil și uneori imposibil de cultivat in vitro, la fel cum nu este ușor de reprodus. bolile pe care le provoacă în condiţii experimentale. Progresele ulterioare în studierea proprietăților virusurilor enteropatogenice și a rolului lor în etiologia bolilor gastrointestinale la păsări vor fi, fără îndoială, asociate cu dezvoltarea unei tehnici pentru cultivarea lor in vitro, utilizarea metodelor moderne de diagnosticare, în special, folosind anticorpi monoclonali și reacția în lanț a polimerazei (PCR).
Gastroenterita virală este larg răspândită în multe țări ale lumii cu creșterea păsărilor dezvoltate, în special în fermele de tip industrial, ceea ce provoacă daune economice semnificative asociate cu plecarea păsărilor de curte, o scădere a indicatorilor de producție ca urmare a scăderii creșterii zilnice în greutate din cauza pierderii. a apetitului şi o creştere a eterogenităţii efectivului.
Leziunile induse de virus ale mucoasei intestinale, în primul rând, servesc ca o poartă de intrare pentru pătrunderea altor agenți patogeni potențiali, cum ar fi Escherichia coli și Salmonella spp. etc.). Leziunile mucoasei duc la o scădere a adsorbției și la descompunerea maltozei, ceea ce duce la o deficiență de vitamine și minerale solubile în grăsimi în organismul păsărilor. Infecția experimentală a puilor de carne cu virusuri enteropatogene provoacă rahitism, osteoporoză și alte leziuni ale scheletului. Tulburările metabolice din organism asociate acestor viruși contribuie la scăderea ratei de creștere a găinilor, atrofia pungii Fabricius și a timusului, ceea ce provoacă, la rândul său, un deficit de imunoglobuline și o creștere a susceptibilității la agenții patogeni ai altor boli infecțioase. Unii virusuri aviare enteropatogene reprezintă o amenințare pentru oameni. În plus, multe virusuri cu rol etiologic neclar au fost identificați la păsări prin microscopia electronică a fecalelor și a conținutului intestinal.
Infecțiile enterovirale ale păsărilor care afectează tractul gastrointestinal sunt polietiologice. În prezent, se știe că cel puțin zece grupuri de viruși sunt implicate în apariția tulburărilor intestinale acute la păsări. Acestea includ rota-, pararotavirusuri-, corona-, entero-, adeno-, rheo-, astro-calicivirusuri-, pestivirusuri- și parvovirusuri, care, cu o scădere a rezistenței globale a organismului, pot provoca pierderi economice semnificative din cauza acumularea altor boli, încălcarea condițiilor de detenție și influența factorilor de mediu nefavorabili.
Această recenzie oferă informații despre rotavirusuri, coronovirusuri, adenovirusuri, reovirusuri, astrovirusuri și parvovirusuri, care provoacă cel mai adesea focare de gastroenterită aviară.
ROTAVIRUSURI
Rotavirusurile provoacă enterită la multe specii de păsări și mamifere, inclusiv la oameni. Pentru prima dată, infecția cu rotavirus cu semne de enterită și creșterea deșeurilor a fost diagnosticată de Bergeland et. al. în 1977 la păsări de curcan. Ulterior, rotavirusurile au fost detectate la găini, fazani, rațe și, de asemenea, la păsările sălbatice.
Rotavirusurile aparțin familiei Reoviridae și sunt sferice, cu un diametru de aproximativ 70 nm. Numele virusului provine de la cuvântul latin „rota” – o roată care caracterizează morfologia virionilor sub forma unei roți dințate. Morfologia rotavirusurilor izolate de la mamifere și păsări este aceeași. Particulele complete de virus constau din capsomere cu două sau un singur strat. Numai virionii cu capsidă dublă au activitate infecțioasă; ajung la 70-75 nm.
Genomul virusului este format din ARN dublu catenar, care conține 11 segmente cu o greutate moleculară totală de 12-20 MDa. Fiecare segment de ARN conține un cadru de citire deschis care codifică o singură proteină. Replicarea și asamblarea rotavirusurilor are loc în citoplasmă, astfel încât particulele de rotavirus se găsesc adesea în vacuole. Rotavirusurile sunt rezistente la eter, pH scăzut (3,0) și relativ rezistente la căldură.
Rotavirusurile aviare sunt clasificate prin reacția încrucișată de imunofluorescență și prin electroforeza pe gel de poliacrilamidă (PAG) a genomului ARN. Rotavirusurile care reacționează în MFA cu seruri specifice la rotavirusurile din grupa A de mamifere sunt clasificate ca rotavirusuri din grupa A. Rotavirusurile cu reactivitate încrucișată slabă cu antigenul rotavirusului A de la mamifer sunt clasificate ca fiind atipice. Acestea din urmă, la rândul lor, au trei grupe antigenic distincte: unul este clasificat ca grup D, celelalte două nu sunt clasificate.
Rotavirusurile din grupa D au fost identificate doar la păsări. Analiza electroforetică în PAG, bazată pe diferența de migrare între diferitele segmente ale genomului rotavirusului, este un instrument important în clasificare și a fost utilizată cu succes pentru evaluarea preliminară a tulpinilor epizootice. Avantajele acestei metode includ faptul că folosește excrementele sau conținutul intestinal al unei păsări bolnave fără izolarea și cultivarea prealabilă a virusului.
Infecția cu rotavirusuri are loc alimentar. Sursa virusului este o pasăre bolnavă și recuperată, cea mai mare cantitate de agent patogen este conținută în așternut. Rotavirusurile se înmulțesc în vilozități diferențiate ale celulelor epiteliale ale intestinului subțire, excreția maximă a virusului cu fecale se observă la 2-5 zile după infectare. În vârful vilozităților, există o migrare accelerată și descuamare prematură a enterocitelor (41), înlocuirea lor cu celule epiteliale imature și cripte, care este cauza procesului de digestie. Celulele imature, nediferențiate, care înlocuiesc celulele distruse de virus, duc la deficiență de maltoză, rezultând o capacitate de adsorbție redusă. Yason și Schat au demonstrat experimental reducerea adsorbției de maltoză în timpul infecției cu rotavirus la curcani folosind D-xiloză în acest scop.
Manifestările clinice ale infecției cu rotavirus aviar variază de la subclinice la severe. Cu infecția experimentală, principalul semn clinic este diareea. În plus, poate exista anxietatea păsărilor, aglomerația, o scădere a creșterii în greutate corporală, deshidratare și o creștere a mortalității. În cazurile severe, moartea păsării are loc în 2-4 zile, risipa este de la 4 la 7%. La fazanii în vârstă de 6-40 de zile, boala se manifestă prin depresie, diaree apoasă și deșeuri crescute (20-30%). Manifestarea clinică a bolii în timpul infecției experimentale a găinilor și păsărilor de curte cu rotavirusuri variază foarte mult: de la medie la inaparentă, care este asociată cu virulența diferită a rotavirusurilor, influența altor infecții, influențele mediului și condițiile de creștere a păsărilor (32).
Durata perioadei de incubație pentru infecția cu rotavirus este de 2-5 zile. Provoacă diaree la curcani și enterită ușoară la pui. Unii oameni de știință au observat o sensibilitate ridicată la infecția experimentală a găinilor și curcanilor adulți în comparație cu cei tineri (69). Rotavirusurile provoacă o producție redusă de ouă la găinile ouătoare.
La autopsia unei păsări moarte, se remarcă deshidratarea cadavrului, paloarea membranei mucoase a tractului intestinal și umflarea cecumului din cauza acumulării de lichid și gaze, precum și inflamația tălpilor extremităților.
Modificările histologice sunt detectate în duoden și intestinul gros. Celulele cilindrice ale vilozităților sunt înlocuite cu cele plate, vilozitățile se scurtează, se contopesc, iar ulterior membrana mucoasă pierde vilozitățile și devine netedă.
Epizootologia, semnele clinice și modificările patomorfologice joacă un rol de sprijin în diagnosticul diareei cu rotavirus. Prezența anticorpilor în serul de sânge al păsărilor nu este, de asemenea, semnificativă, deoarece aceștia sunt înregistrați la majoritatea păsărilor adulte. Diagnosticul infecției cu rotavirus se bazează de obicei pe detectarea și identificarea virusului sau a antigenului viral folosind microscopia electronică (EM) sau imunoelectronă a unei probe de excremente, conținut intestinal sau răzuire din membrana mucoasă a intestinului subțire. Metoda anticorpilor fluorescenți este utilizată pe scară largă în studiul frotiurilor fecale, amprentelor și secțiunilor creostatice ale intestinului subțire, precum și culturilor de celule infectate.
Examinarea gunoiului folosind EM este cea mai sensibilă metodă de detectare a rotavirusurilor, indiferent de serogrupurile acestora. EM imun și metoda anticorpilor fluorescenți (MFA) sunt utilizate pentru a identifica serogrupurile de rotavirusuri. S-a stabilit că detectarea ARN-ului rotavirus în fecale în PAG nu este inferioară ca sensibilitate la EM.
Datorită dificultății de cultivare a rotavirusurilor în cultura celulară, izolarea agentului patogen nu este întotdeauna efectuată la diagnosticarea unei boli. Până în prezent, în cultură celulară sunt cultivate numai rotavirusuri de grup A și, cu rare excepții, tulpini individuale de serogrup D. Pentru a face acest lucru, utilizați o cultură de celule transplantate MA-104 sau culturi primare de celule hepatice de embrioni de pui și rinichi de pui. Adăugarea de tripsină (1–10 µg/mL) la mediul de întreținere crește de 100–1000 de ori acumularea de rotavirusuri în liniile celulare transplantate și în cultura de rinichi primar. Autorii cred că tripsina crește permeabilitatea membranelor celulare și, prin urmare, facilitează pătrunderea virusului în celule.
Rotavirusurile sunt excretate în așternut în cantități mari și sunt relativ rezistente la diverși factori fizici și chimici. Ele rămân în așternut mult timp, contaminând articolele de îngrijire, precum și teritoriul fermei de păsări. În plus, transmiterea transovariană a agentului patogen nu este exclusă, așa cum demonstrează detectarea rotavirusurilor la puii de o zi. Este posibil ca rotavirusul să rămână pe coaja sau în interiorul oului, iar după ecloziunea în masă a puietului să fie reinfectat. Purtătorii de virus la păsările de curte, precum și vectorul de transmitere a agentului patogen, nu au fost pe deplin studiate.
Nu au fost dezvoltate metode de tratament și prevenire specifică a infecției cu rotavirus. Ubicuitatea rotavirusurilor și persistența acestora împiedică bunăstarea durabilă a întreprinderilor de păsări. Prevenirea acestei boli se reduce la înlocuirea în timp util a așternutului în adăposturile de păsări disfuncționale și dezinfectarea spațiilor, ceea ce reduce gradul de contaminare a mediului și riscul de infecție a păsărilor. Dacă apare boala și apare diareea, răspândirea infecției este facilitată de așternutul insuficient. Măsurile de îmbunătățire a sistemului de ventilație, optimizarea temperaturii și adăugarea de lenjerie de pat proaspătă ajută la reducerea răspândirii infecției cu rotavirus și a manifestării consecințelor negative.
ENTERITA CORONAVIRUSĂ A CURCILOR
Enterita cu coronavirus din Turcia este o boală gravă care afectează curcanii de toate vârstele. Puii, fazanii, prepelițele sunt imune la agentul cauzal al acestei infecții. Enterita cu coronavirus este înregistrată în SUA, Canada, Austria și India. În creșterea curcanilor pe tot parcursul anului, cei mai comuni agenți etiologici ai gastroenteritei (reprezentând aproximativ 50% din toate cazurile de diaree) sunt coronavirusurile și este extrem de dificil să îmbunătățiți astfel de ferme.
Agentul cauzal al bolii este un virus care conține ARN din familia Coronaviridae. Virușii acestei familii au o morfologie caracteristică: sunt polimorfi, înveliți, diametrul virionilor este de la 60 la 220 nm, lungimea este de 12-24 nm, suprafața virionilor este în formă de petală. Coronavirusurile conțin cel puțin trei proteine structurale majore, inclusiv o glicoproteină mare sub formă de proeminențe pe suprafața virionilor (peplomeri) (S), o glicoproteină cu anvelopă mică (M) și o proteină nucleocapsidă (N).
Replicarea coronavirusului are loc exclusiv în citoplasmă. Coronavirusurile sunt cultivate în embrioni de pui sau de curcan prin inocularea virusului în cavitatea amniotică. Până acum, doar izolatul de coronavirus din Quebec a fost adaptat și cultivat cu succes în linia celulară de adenocarcinom uman (HRT). Replicarea virusului depindea de încorporarea tripsinei în mediu și de controlul strict al pH-ului.
Studiile în microscopia electronică imunitară, reacția de inhibare a hemaglutinării și reacția de neutralizare au stabilit o diferență antigenică între coronavirusul de curcan și virusul bronșitei infecțioase de pui. Cu toate acestea, reacția încrucișată de imunofluorescență a relevat o relație antigenică între acești agenți patogeni și diferența lor față de coronavirusurile de la mamifere. Toate tulpinile epizootice de coronovirusuri de curcan aparțin aceluiași serotip.
Infecția experimentală este posibilă cu administrarea orală și intraperitoneală de material viral. Introducerea unui omogenat din punga Fabricius al unei păsări bolnave la curcanii adulți determină o evoluție acută a bolii. Perioada de incubație este de 1-3 zile. Boala se manifesta prin depresie, diaree apoasa, scadere in greutate si deshidratare. La păsările de curcan și la curcanii tineri de înlocuire, boala apare brusc. Pielea din zona capului și din alte părți vizibile ale corpului se întunecă, capul se aruncă înapoi. Pe măsură ce boala progresează, o parte semnificativă a gunoiului este formată de urati. Incidența ajunge de obicei la 100%, deșeurile variază de la 5 la 50%. Leziunile sunt de obicei observate în intestinul subțire, plin cu conținut apos, gazos.
Virusul este excretat în fecale timp de câteva luni și se transmite pe cale fecal-oral, astfel încât un individ mai în vârstă poate fi o sursă de infecție și poate infecta animalele tinere. Transmiterea virusului este posibilă mecanic - prin personalul de service, articole de îngrijire, transport, precum și păsări care zboară liber. În mediul extern, virusul poate persista ani de zile. Transmiterea transovariană a agentului patogen și vectorul de transmitere a virusului nu au fost stabilite.
Diagnosticul pe baza semnelor clinice sau a leziunilor patologice este dificil. Diagnosticul de laborator se bazează pe izolarea virusului în embrionii de pui și curcan, pe detectarea acestuia prin microscopie electronică, MFA sau folosind studii serologice.
Pentru a izola virusul, materialul care conține virusul este introdus în cavitatea amniotică a embrionilor după 6-7 zile de incubație, urmată de identificarea virusului în preparate din intestinul subțire al embrionului în MFA. MFA poate fi utilizat pentru a detecta antigenul viral în epiteliul intestinului subțire și bursa curcanilor bolnavi. La efectuarea microscopiei electronice, sunt posibile rezultate fals pozitive datorită prezenței în probele studiate a fragmentelor de membrane celulare care au un aspect asemănător coronavirusului.
Metoda preferată pentru detectarea patogenului este EM imună folosind seruri imune specifice. Pentru a identifica virusul, secțiunile criostate ale intestinelor embrionilor de curcan infectați sunt examinate printr-un test de imunofluorescență indirectă.
Pentru ameliorarea fermelor nefavorabile infecției cu coronavirus, după atingerea condițiilor de sacrificare, pasărea bolnavă este predată pentru carne, urmată de curățarea și dezinfecția localului. Igienizarea spațiilor pentru o perioadă de 3-4 săptămâni este foarte eficientă în prevenirea bolii.
ENTEROVIRUSURI
În ultimii ani, s-a descoperit că unii virusuri asemănătoare enterovirusurilor cauzează gastroenterită la pui și curcani. Acești agenți au fost clasificați ca agenți de tip enterovirus (EPV) deoarece nu au fost identificați în mod clar. Pe baza dimensiunii particulelor virale, morfologiei, morfogenezei și detectării în așternut, acestea sunt clasificate ca enterovirusuri, cu toate acestea, sunt necesare studii biologice și fizico-chimice suplimentare ale agentului patogen pentru o clasificare precisă.
Enterovirusurile aviare sunt răspândite în întreaga lume. Au fost identificați la pui și curcani din Irlanda de Nord, SUA, Franța, Malaezia.
Enterovirusurile sunt membri ai unuia dintre cele nouă genuri care alcătuiesc familia Picornaviridae. Picornavirusurile nu sunt învăluite, au formă icosaedrică. Diametrul particulelor virale este de 22-30 nm. Virionii nu au trăsături caracteristice, conțin ARN cu polaritate pozitivă monocatenar, care este infecțios.
Genurile din familia Picornaviridae sunt împărțite în funcție de sensibilitatea enterovirusurilor la acizi, densitatea virionilor în clorură de cesiu și de prezentarea clinică la pasărea infectată. Enterovirusurile sunt rezistente la pH 3, precum și la eter, cloroform și alcool, ceea ce indică absența lipidelor în ele. Nu există în literatură date despre sensibilitatea lor la dezinfectanți.
Enterovirusurile sunt cultivate pe embrioni de pui de 6 zile, aproximativ 50% dintre embrioni murind în 3-7 zile. Unele tulpini de enterovirusuri se pot multiplica pe membranele corion-alantoide ale embrionilor (CAM). Pentru cultivarea tulpinilor FP3 și 612, se utilizează o cultură primară de celule de ficat și rinichi de pui. Prezența virusului în cultura celulară este determinată în MFA, deoarece efectul citopatic este slab exprimat sau complet absent.
Enterovirusurile de curcan sunt cultivate pe embrioni de curcan de 18 zile. Replicarea virusului este stabilită în intestinele embrionilor. La embrionii infectați, duodenul, jejunul și ileonul sunt palide și edematoase. Virusul este detectat în secțiunile criostate ale intestinului și în conținutul său folosind un microscop electronic și MFA.
Replicarea enterovirusurilor are loc în citoplasma enterocitelor situate între vârful și baza vilozităților, cea mai mare concentrație de virus fiind detectată direct în apropierea criptelor. Structura cristalină a virusului include particule mici, rotunde, asemănătoare virusului, cu un diametru de aproximativ 23 nm. S-a stabilit experimental că enterovirusurile curcanilor și găinilor se înmulțesc în principal în epiteliul intestinului subțire, ileon și rinichi.
În condiții naturale, pasărea se infectează cu enterovirusuri ca urmare a ingerării excrementelor infectate. Nu există dovezi concludente ale transmiterii transovariene a virusului. Cu toate acestea, izolarea enterovirusului din deșeurile de incubație indică posibilitatea transmiterii acestuia prin ou, cel puțin pentru unele tulpini.
Introducerea orală a unui enterovirus în gazda naturală la o vârstă fragedă provoacă enterita sau întârzierea creșterii, în funcție de proprietățile biologice ale virusului. La puii SPF infectați cu enterovirusuri izolate în Japonia, au fost observate diaree și mortalitate ridicată (până la 53,3%) în decurs de 6 zile de la infectare. Cu ajutorul EM, virusul poate fi detectat în conținutul intestinului la 1-3 zile după infectare. Cu gunoiul, este excretat în 14 zile după infectare. Cu toate acestea, trebuie remarcat faptul că enterovirusurile sunt detectate chiar și la păsările SPF.
La curcani, în a 4-a zi după infectare, se observă depresie, excremente apoase, iar în a 8-a zi a experimentului, o scădere semnificativă a creșterii în greutate corporală. La autopsie, ei dezvăluie o îngroșare și expansiune a cecumului datorită acumulării unui lichid spumos galben, se observă mucus cataral în intestinul subțire. La autopsie, puii infectați cu enterovirusuri izolate în Japonia prezintă nefroză și depunere de urati în organele interne. Examenul histologic a evidențiat o scădere a lungimii vilozităților în duoden și alungirea criptelor din ileon și duoden.
În scopuri de diagnostic, așternutul este examinat în EM și MFA. În plus, diagnosticul poate fi efectuat prin detectarea antigenului viral în țesuturile intestinale sau în așternut folosind MFA sau ELISA. Izolarea virusului nu este utilizată pe scară largă, deoarece majoritatea enterovirusurilor sunt slab adaptate sau nu sunt cultivate în cultura celulară și embrioni. Potrivit multor cercetători, sarcina cea mai urgentă și, în același timp, dificilă în studiul enterovirusurilor este de a determina gradul de participare a acestora la patologia infecțioasă a păsărilor.
ENTERITA HEMORAGICĂ A CURCILOR
Enterita hemoragică este o boală virală acută a curcanilor care durează 7-10 zile. Manifestarea clinică a bolii în majoritatea cazurilor se observă la curcani cu vârsta cuprinsă între 4 și 12 săptămâni. Perioada de incubație durează 3-6 zile. O pasăre bolnavă este deprimată, refuză să se hrănească, are diaree, așternut amestecat cu sânge și moarte subită. În condiții naturale, mortalitatea variază de la 1 la 60%, iar cu infecția experimentală ajunge la 80%.
Virusul enteritei hemoragice a curcanului (GEI) cauzează pierderi economice semnificative. Boala este raportată în majoritatea fermelor de curcani, în special în Canada, Anglia, Germania, Australia, India, Israel și Japonia. Pe baza studiilor morfologice, histologice, imunologice și a rezistenței la cloroform, virusul GEI, ca și virusul splinei fazanului marmorat (MSV), este atribuit grupului II al familiei Aviadenoviridae, genul Aviadenovirus.
Adenovirusurile sunt viruși icosaedrici neînveliți. Diametrul lor este de 70-90 nm. Genomul virusului este reprezentat de un ADN liniar dublu catenar cu o greutate moleculară de 20–30 MDa.
Adenovirusurile din grupa II sunt unite de un antigen de grup comun, care diferă de antigenul adenovirusurilor din grupa I. Adenovirusurile din grupa III includ virusul sindromului picăturii ouălor (EDS-76), care nu este asociat cu gastroenterita aviară în creșterea industrială a păsărilor de curte. Adenovirusurile din grupa II se reproduc slab în culturile standard de celule aviare.
Inițial, virusul GEI se reproduce în celulele sistemului reticuloendotelial. Se cultivă în celule limfoblastoide și culturi de leucocite de curcan.
Temperaturile ridicate și expunerea la diverși dezinfectanți inactivează virusul. Este însă rezistent la solvenții grăsimi (cloroform, alcool) și poate fi păstrat timp îndelungat la un anumit regim de temperatură: 6 luni la 4°C și 4 săptămâni la 37°C. În carcasele de păsări, virusul persistă la 37°C timp de câteva săptămâni.
La deschiderea curcanilor, leziunile caracteristice se găsesc în principal în splină și intestine. Splina este mărită, se observă hemoragii pete pe suprafața organului. Mucoasa intestinală este laxă, edematoasă, cavitatea sa este umplută cu exsudat de sânge, epiteliul din partea superioară a vilozităților este degenerat, vârfurile vilozităților sunt exfoliate și se observă hemoragii în lumenul intestinal. În plus, s-au observat hiperplazia pulpei albe și necroza limfocitelor în splină și, în unele cazuri, prezența incluziunilor caracteristice în nucleii celulelor sistemului reticuloendotelial. Mecanismul de participare a virusului la dezvoltarea patologiei intestinale și a hemoragiilor în acesta nu este complet clar, deoarece virusul GEI nu se înmulțește în epiteliul intestinal. S-a dovedit că virusul GEI se reproduce în celulele endoteliale intestinale, ceea ce poate duce la leziuni vasculare și necroză ischemică a vilozităților intestinale. Se presupune că acest mecanism de acțiune este caracteristic infecției cu adenovirus la vaci.
Virusul GEI se transmite pe cale fecal-oral. Virusul poate persista mult timp în așternutul contaminat și pare a fi un factor de transmitere a infecției către efectivele ulterioare de curcani. Transmiterea mecanică a agentului patogen între stolurile de păsări infectate și cele sensibile poate fi, de asemenea, o cale importantă de transmitere a virusului. Transmiterea agentului patogen de la purtătorii de virus (inclusiv calea transovariană), precum și vectorul de transmitere a virusului, nu au fost stabilite definitiv.
Diagnosticul virusului enteritei hemoragice se poate baza pe histopatologie, izolarea virusului, studii serologice și metode de detectare a antigenului. Diagnosticul histologic se bazează pe identificarea incluziunilor intranucleare caracteristice în celulele splinei sau intestinelor. Izolarea virusului se realizează prin inocularea orală a splinei sau a omogenatului intestinal la puii de 5-10 săptămâni. De regulă, moartea are loc la 3-6 zile după ce sunt infectați cu material patologic. Puii morți sunt examinați pentru natura leziunilor. Virusul poate fi izolat și în cultura de celule limfoblastoide de curcan. Pentru diagnosticul serologic se poate folosi testul de precipitare cu gel de agar sau ELISA. Virusul poate fi detectat în cultura de țesut sau de celule folosind MFA, EM, testul de precipitare cu gel de agar sau ELISA.
Pentru prevenirea BEI în zonele endemice, se utilizează vaccinarea prin udare cu tulpini avirulente de câmp ale virusului BEI sau virusului MSF, precum și virusuri strâns înrudite care nu sunt patogeni pentru curcani. În prezent, două tipuri de vaccinuri vii sunt utilizate pe scară largă pentru imunizarea curcanilor prin metoda de udare. Unul este un omogenat brut de splină obținut de la puii de 4-6 săptămâni infectați cu GEI sau MSDV avirulent. O alternativă, vaccin viral viu poate fi preparat prin atenuarea tulpinilor avirulente de virus GEI sau MSF în cultura de celule limfoblastoide. Imunizarea curcanilor la vârsta de 4-6 săptămâni asigură formarea unei imunități stabile pe termen lung, care este garantată pentru a proteja pasărea de infecția cu izolate de câmp.
ASTROVIRUSURI
În 1980 McNulty et al. la microscop electronic, astrovirusurile au fost detectate pentru prima dată în conținutul intestinal al curcanilor de 11 zile cu semne de enterită. Mai recent, Reynolds et al. a arătat că infecția cu astrovirus a curcanilor este larg răspândită în Statele Unite și a dovedit natura enteropatogenă a acestor virusuri.
Astrovirusurile sunt un grup mic de viruși care sunt sferici și de dimensiuni mici. Numele provine de la cuvântul grecesc „astron” - o stea, care reflectă forma tipică de stea a virionului, care are 28-31 nm în diametru. Structura biochimică a astrovirusurilor este puțin înțeleasă, deoarece nu este posibilă cultivarea lor in vitro.
Astrovirusurile sunt răspândite. Potrivit unor autori, în 80% dintre fermele de păsări chestionate, infecțiile intestinale au fost cauzate de astrovirusuri. Infecția cu astrovirus este mai frecventă la animalele tinere până la vârsta de o lună și mult mai puțin frecvent la curcanii adulți. Semnele clinice sunt variate, incluzând diaree, agitație, scăderea apetitului și ritmul de creștere. Morbiditatea este de obicei mare, dar mortalitatea este scăzută.
La păsările SPF infectate experimental, s-a observat o scădere a creșterii în greutate și o scădere a adsorbției de D-xiloză în comparație cu grupul de control. Infecția experimentală a găinilor SPF provoacă scăderea poftei de mâncare, diaree. La autopsie, se observă extinderea cecumului datorită acumulării unei mase galbene, spumoase, scăderii tonusului intestinal și consistenței spumoase a conținutului său. Principala cale de transmitere a virusului este fecal-oral, alte căi nu au fost încă identificate.
Principala metodă de diagnosticare a infecției cu astrovirus este microscopia electronică sau EM imună a probelor de fecale și conținut intestinal. Atunci când se efectuează studii de microscopie electronică, trebuie să se țină cont de faptul că astrovirusurile pot fi confundate cu alți viruși mici rotunjiți, cum ar fi enterovirusurile. Diagnosticul în EM se face pe baza dimensiunii particulelor virale și a caracteristicilor morfologice ale structurii de suprafață; prin urmare, cel mai preferat este diagnosticul infecției cu astrovirus folosind EM imun.
Nu au fost elaborate măsuri specifice pentru prevenirea infecției cu astrovirus. Controlul acestuia se efectuează cu respectarea măsurilor preventive generale: înlocuirea în timp util a așternutului, curățarea și dezinfectarea spațiilor la primirea următorului lot de păsări de curte.
REOVIRUSURI
Reovirusurile aviare sunt omniprezente; în prezent, aproximativ 11 serotipuri au fost izolate și studiate. Pentru prima dată în 1954 J.E. Fahey și J.F. Crawley a izolat reovirusul de la pui care prezintă semne de boală respiratorie. Semnele clinice ale bolii cauzate de reovirus au fost descrise de P.J. Dalton R. și Henry în 1967, numind-o tenosinovită. Cu toate acestea, multe probleme legate de reovirusurile aviare nu sunt bine înțelese.
În prezent, literatura de specialitate a acumulat suficiente informații despre izolarea reovirusurilor în diferite procese patologice la găini, manifestate sub formă de enterită, sinovită, miocardită, pericardită, salpingită, sindrom de absorbție slabă, sindrom de penaj slab etc. . Cu toate acestea, nu există motive suficiente pentru a considera că reovirusurile aviare sunt singurii agenți etiologici ai unei game largi de boli cu semne clinice atât de diferite. Multe dintre aceste simptome sunt descrise în boli asociate cu agenți patogeni ai altor infecții virale și bacteriene.
Reovirusurile aviare au fost asociate cu o gamă largă de boli la păsările de curte, inclusiv artrita/tenosinovita, bolile respiratorii, enterita și sindromul malabsorbtiv nanism. Cu toate acestea, cu excepția artritei virale/tenosinovitei, rolul etiologic al reovirusurilor în aceste boli rămâne nedovedit. Reovirusurile aviare sunt răspândite în întreaga lume; ele sunt adesea izolate din așternutul și țesuturile păsărilor nu numai bolnave, ci și sănătoase clinic.
Reovirusurile aviare sunt rezistente la mediul extern și la diverși factori fizici și chimici. Activitatea infecțioasă a materialului gălbenuș care conține virusuri nu scade la 60°C timp de 8-10 ore, 56°C - 24 ore, 37°C - 16 săptămâni, 22°C - 51 săptămâni, 4°C - 3 ani, minus 20 °C - 4 ani și minus 63 °C - până la 10 ani. Titrul virusului insuficient purificat la 60°C scade în 5 ore, dar inactivarea completă nu are loc. Când agentul patogen este încălzit în prezența clorurii de magneziu, activitatea infecțioasă se stabilizează. Înghețarea și decongelarea repetată nu afectează activitatea sa biologică. Reovirusurile sunt rezistente la radiațiile UV, eter, tolerează o gamă largă de pH, dar sunt sensibile la cloroform.
Reovirusurile aviare nu sunt învelite, conținând două vertebrate capside icosaedrice cu diametrul de 50–70 nm. Genomul este reprezentat de 10-12 segmente liniare de ARN dublu catenar cu o greutate moleculară totală de 12-20 MDa. Replicarea și asamblarea reovirusurilor aviare are loc în citoplasmă, uneori cu formarea de incluziuni paracristaline.
Reovirusurile aviare au un antigen de grup comun de suprafață, care în majoritatea cazurilor este determinat în MFA sau prin precipitare într-un gel de agaroză. Cu ajutorul testului de neutralizare a fost demonstrată eterogenitatea antigenică a reovirusurilor aviare, în timp ce au fost identificate 11 serotipuri ale agentului patogen. De asemenea, a fost stabilită variabilitatea patogenității reovirusurilor aviare.
Cu infecția cu reovirus, s-a dovedit transmiterea verticală a agentului patogen. Nivelul transmiterii transovariene a virusului a fost nesemnificativ. Reovirusurile situate pe suprafața cochiliei, precum și în interiorul oului, pot participa atât la transmiterea orizontală, cât și la cea verticală a agentului infecțios.
În multe lucrări dedicate studiului patogenezei infecției cu reovirus la păsări, s-a stabilit că intestinul este ținta principală a virusului, indiferent de metoda de introducere a acestuia. După infecția orală sau aerogenă, agentul patogen intră în sânge și, ca urmare a viremiei, se răspândește rapid în diferite organe și țesuturi. În special, virusul poate fi izolat din intestine, bursa lui Fabricius, ficat, pancreas, inimă, rinichi, articulații și tendoane. Jones şi colab. a arătat că reovirusurile se reproduc mai întâi în epiteliul vilozităților intestinului subțire și bursa lui Fabricius, apoi se răspândesc în alte organe. Sindromul de malabsorbție se caracterizează prin mărirea stomacului glandular, uneori cu necroză și semne de enterită hemoragică catarrală.
Se știe că reovirusurile sunt adesea izolate de enterită, sindrom malabsorbție și sindromul de mortalitate crescută al păsărilor, cu toate acestea, rolul lor etiologic în patogenia acestor boli nu a fost pe deplin studiat. S-a stabilit că reovirusurile au un efect imunosupresor asupra organismului unei păsări bolnave, iar acest lucru contribuie la creșterea patogenității altor agenți infecțioși, inclusiv coccidii, Cryptosporidium spp. , Escherichia coli și agentul cauzal al anemiei aviare. Este posibil ca imunosupresia să fie și o cauză a manifestărilor unor boli precum malabsorbție și sindrom de mortalitate aviară crescută.
Diagnosticul infecției cu reovirus se bazează pe izolarea virusului în cultura celulară și embrionii de pui. Diagnosticul serologic al bolii se realizează folosind un test de neutralizare, un test de imunofluorescență indirectă și ELISA pentru a detecta anticorpi specifici grupului. Diagnosticul retrospectiv al infecției cu reovirus nu este foarte informativ din cauza răspândirii largi a virusului și a prezenței formelor subclinice de infecție.
Pentru a preveni introducerea infecției în fermele de păsări, este necesar să se respecte regulile veterinare și sanitare, regimul „totul este gratuit - totul este ocupat” și principiul izolării spațiale a unităților și zonelor de producție.
Cel mai bun dezinfectant pentru camere este o soluție alcalină fierbinte.
parvovirusuri
Se știe că parvovirusurile cauzează gastroenterită la diferite specii de mamifere, în special câini, pisici și vaci. Se crede că ei sunt cauza sindromului malabsorbție la păsări și enterita la curcani, dar rolul lor în patogeneza acestor boli nu a fost stabilit definitiv.
Nu au înveliș, au formă icosaedrică, dimensiunea virionilor este de 18-26 nm, iar structura suprafeței nu este exprimată. Virusul conține ADN liniar monocatenar cu o greutate moleculară de aproximativ 20 MDa. Parvovirusurile se replic în nucleul celulelor, unde formează adesea incluziuni.
Replicarea parvovirusului depinde de factorii care se formează în celule în timpul fazei S a ciclului celular, astfel încât replicarea și efectul patogen apar în principal în celulele cu un grad ridicat de proliferare. Infecția cu parvovirus a celulelor criptelor și a epiteliului germinativ al intestinului duce la o scădere a numărului de celule de adsorbție care sunt eliminate din vârful vilozităților. Deteriorarea vilozităților provoacă atrofie celulară, scăderea capacității lor de adsorbție și apariția diareei.
Parvovirusurile au fost descrise la pui și curcani, dar patogenitatea acestor virusuri și rolul lor ca agenți cauzali ai gastroenteritei la aceste specii de păsări nu este în prezent complet clar. Kisary și colab. a descris parvovirusul și virusurile similare la pui. Virusul a fost identificat ca un parvovirus pe baza morfologiei, mărimii, densității în CsCl (1,42 până la 1,44 g/mL) și prezenței ADN-ului monocatenar (aproximativ 5,2 kb în dimensiune).
Infecția experimentală a găinilor broiler de o zi provoacă diaree, o scădere a greutății corporale cu 40% și o încetinire a dezvoltării. Cu toate acestea, în experimentele efectuate de Decaestestecker și colab., nu a existat nicio manifestare a semnelor clinice și o scădere a creșterii în greutate, ca în cazul infecției experimentale cu parvovirus SPF-pui și pui broiler.
Diagnosticul infecției cu parvovirus se realizează folosind EM și MFA. Pentru cercetarea în EM, conținutul intestinului este purificat preliminar într-un gradient de CsCl pentru a fi eliberat de alți virusuri mici. În plus, este necesar să se efectueze studii biochimice pentru a studia genomul virusului. MFA este o metodă de diagnosticare simplă și rapidă, cu toate acestea, producerea acesteia necesită prezența unui antiser specific, care nu este întotdeauna disponibil.
Trambel și colab. a descris un virus asemănător cu parvovirusul curcanului. Agentul patogen a provocat enterita la puieții de curcan de 1-5 săptămâni. A fost identificat pe baza detectării histopatologice a incluziunilor intranucleare în enterocite intestinale, precum și a detectării particulelor hexagonale de 15-20 nm folosind EM în strat subțire.
În purificat centrifugare În așternutul unei păsări bolnave, virusul poate fi detectat la microscop electronic. Studiul frotiurilor fecale și secțiunilor membranei mucoase a intestinului subțire prin microscopie imunoelectronică poate dezvălui antigenul viral.
Listăliteratură
1. Anderson A.A. în: Diagnostic comparativ al bolilor virale. 1981. Academic Press, New York, NY., pp. 4–66.
2. Andral B., Toquin D. Observations et isoelements de psendopicornavirus a partir de dindonneaux ma lades // Avian Pathol, 1984 13:377–388.
3. Barnes H.J. în: Bolile Poultrv. a 10-a ed. 1997. Iowa State University Press, Ames, IA. P. 683–686
4. Barnes H.J., Guy J. în: Diseases of Poultry. a 10-a ed. 1997. Iowa State University Press, Ames, I A. Paginile 1023–1031.
5. Benfield D.A. în: Diaree virale ale omului și animalelor. 1990. CKC Press, Boca Raton, FL. Paginile 113–133.
6. Bergeland M.E., McAdaragh J.P., Stotz I. Enterita rotaviral la turkey poults. în: Proceedings of the 26th Western Poultry Disease Conference. 1977. P. 129–130.
7. Berns K.I. Replicarea parvovirusului // Micro. Rev., 1990. 54: 316–329.
8. Bridger J.C. în: Diaree virale ale omului și animalelor. 1990. CRC Press, Boca Raton, FL. Paginile 161–182.
9. Cavanagh D. Polipeptide structurale ale coronavirusului 1BV // J. Gen. Virol., 1981. 53:93–103.
10. Chooi K.F., Chilian U. Broiler runting/stutting syndrome in Malaysia, Vet. Rec., 1985. 116:354.
11. Dea S., Marsolais G., Beaubien J., Ruppanner R. Coronaviruses asociate cu focare de enterita transmisibilă a curcanilor în Quebec: proprietăți de hemaglutinare și cultivare celulară // Avian Dis., 1986. 30:319–326.
12. Decaesstecker M.. Charlier G., Meulemans G. Significance of parvoviruses, entero-like viruses and reoviruses in the etiology of the chicken malabsorption syndrome // Avian Pathol., 1986. 15:769–782.
13. Engstrom B.E., Fossum O., Luthman, Bluenving M. Disease: infecție experimentală cu un izolat suedez de agent de anemie de pui ca Reovirus aviar // Avian Pathol. J., 1988. 17:33–50.
14. Estes M.K. în: Virologie. a 2-a ed. 1990. Raven Press. New York, NY P. 1329–1352.
15. Fadly A.M., Nazerian K., Nagaraja K., Below G. Field vaccination against hemorrhagic enteritis of turkeys // Avian Dis., 1985. 29:768–777.
16. Goodwin M.A. Ventriculita cu corp de incluziune a adenovirusului la pui și prepeliță bobvvhite captive (Colinus virginianus) // Avian Dis., 1993. 37:568–571.
17. Goodwin M.A., Hill D.L., Dekich M.A., Putnam M.R.. Infecția cu adenovirus multisistemic la puii de carne cu hipoglicemie și mortalitate crescută // Avian Dis., 1993. 37:625–627.
18. Guy J.S., Levy M.G., Ley D.H., Bamesrand H.J., Cerig T. M. Reproducerea experimentală a enteritei la prepelița bobwhite (Colinus virginianus) cu Cryptosporidium și Reovirus // Avian Dis. 1987. 31:713–722.
19. Guy ].S., Barnes H.J. Caracterizarea parțială a unui virus asemănător cu enterovirusul de curcan // Avian Dis., 1991. 35:197–203.
20. Guy J., Barnes H.J., Smith L.G., Breslin J. Caracterizarea antigenică a unui coronavirus identificat la curcanii afectați de enterita de păsări de curte și sincromul mortalității // Avian Dis., 1997. 41:583–590.
21. Hayhow C.S., Saif Y.M., Kerr K.M., Whitmover R.E.. Observații suplimentare privind infecția cu enterovirus la păsările de curcan fără agenți patogeni specifici // Avian Dis. 1993. 37: 124–134.
22. Hayhow C.S., V.M. Saif. Învelirea unui test imunosorbent legat de enzime de captare a antigenului pentru detectarea enterovirusului la curcani comerciali // Avian Dis., 1993. 37:375–379.
23. Joklik I.V.K. Structura și funcția genomului reovirusului // Micro. Rev., 1981. 45:483–501.
24. Jones, R. Islam C.M.R., Kelly D.F. Patogeneza timpurie a infecției experimentale cu reovirus la pui // Avian Pathol., 1989. 18:239–253.
25. Kibenge F.S.B., Gwae G.E., Jones R.C., Chapman A.P., Savage C.E. Infecția experimentală cu reovirus la pui: observații privind viremia precoce și distribuția virusului în măduva osoasă, ficat și țesuturile enterice // Avian Pathol., 1985. 14:87–98.
26. Kisary J., Nagy B., Bitay Z.. Prezența par-Vovifuses în intestinul găinilor care prezintă sindrom de piperizare // Avian Pathol., 1984. 13:339–343.
27. Kisary J. Infecție experimentală cu embrioni de pui și pui de o zi cu parvovirus de origine puie // Avian Pathol., 1985. 14:1–7.
28. Kisary J. Imunofluorescența indirectă ca instrument de diagnostic pentru infecția cu parvovirus la pui // Avian Pathol., 1985. 14: 269–273.
29. Kisary J., Avalosse B., Miller-Faures A., Rommelaere J.. Genomul unui nou virus de pui îl identifică ca parvovirus // J. Gen. Virol., 1985. 66:2259–2263.
30. Kouvvenhoven B., Daveiaar F. G., J. Van Yvalsum. Proventriculită infecțioasă care provoacă alergare la puii de carne // Avian Pathol. 1978. 7:183–187.
31. McFerran J.B. în: Bolile păsărilor de curte. a 10-a ed. 1997. Iowa State University Press, Ames, IA. P. 607–620.
32. McNulty M.S. în: Bolile păsărilor de curte. a 10-a ed. 1997. Iowa State University Press, Ames, IA. p. 692–701.
33. McNulty, M.S., McFerran J.B. în: Virus Infections of Vertebrates. Vol. 4. 1993. Elsevier Science Publishers, New York, NY. P. 519–529.
34. McNulty M S., Guy J.S. în: Bolile păsărilor de curte. a 10-a ed. 1997. Iowa State University Press, Ames, IA. P. 706–710.
35. McNulty M."s., Allan G.M., Todd D., McFerran B.. Izolarea și propagarea culturilor celulare a rotavirusurilor de la curcani și găini // Arch. Virol., 1979a. 61:13–21.
36. McNulty M.S., Curran W.L., Todd D., McFerran J.B.. Detectarea virusurilor în fecale aviare prin microscopie electronică directă // Avian Pathol. 1979b. 8:239-247.
37. McNulty M.S., Curran VV.L., McFerran J.B.. Determinarea astrovirusurilor în fecalele de curcan prin microscopie electronică directă, Vet. Rec.1980. 106:561.
38. McNulty M.S., Allan G.M., Todd D., McFerran J.B., McCracken M.. Izolarea de la pui a unui rotavirus 1 lipsit de antigenul grupului rotavirus. J. Gen. Virol., 1981. 55: 405–413.
39. McNulty M.S., Allan G.M., McCracken R.M.. Infecție experimentală la pui cu rotavirus: constatări clinice și virologice // Avian Pathol., 1983. 12:45–54.
40. McNulty M.S., Allan G.M., McFerran J.B.. Isolation of a new avian entero-like virus // Avian Pathol., 1987. 16:331–337.
41. Luna H.W. Mecanisme în patogeneza diareei: o revizuire // J. Am. Veterinar. Med. Asoc., 1978.172:443–446.
42. Xazerian K., Fadly A.M.. Propagation oi virulent and a virulent turkey hemorhagic enteritis virus in cell culture // Avian Dis., 1982. 26:816–827.
43. Orr J.P. Enterita necrozantă la un vițel infectat cu adenovirus // Can. Vet., 1984. 25:72.
44. Panigrahy B., Nacji S.A., Hall C.F.. Izolarea și caracterizarea virusurilor oi asociate cu enterita transmisibilă (blucomb) oi curcani // Avian Dis. 1973. 17:430–438.
45. Paradiso P.R., Rhone S.L., Cantareata I.I. Parvovirusul canin: o caracterizare biochimică și ultrastructurală // J. Gen. Virol., 1982. 62:113–125.
46. Pierson F.VV., Domermuth S.N. în: Bolile păsărilor de curte. a 10-a ed. 1997. Iowa State University Press, Ames, IA. P. 624–633.
47. Pomeroy B.S., Larson C.T., Deshmukh D.R., Patel B.L.. Imunitatea la enterita transmisibilă (coronavirală) a curcanilor (blucomb) // Am. J. Vet. Res., 1975. 36:553–555.
48 Pomeroy B. S. și K. V. Xagaraja. în: Boli ale păsărilor de curte. a 9-a ed. 1991. Iowa State University Press, Ames, I A. Paginile 621–627.
49. Reynolds D. L, Saif W. V. Astrovirus: o cauză a unei boli enterice la păsările de curcan // Avian Dis., 1986.30:89–98.
50. Reynolds D.L, Saif Y.M., Theil K.VV. Un studiu asupra virusurilor enterice ale păsărilor de curte // Avian Dis. , 1987. 31:89–98.
51. Reynolds D.L. în: Bolile păsărilor de curte. a 10-a ed. 1997. Iowa State University Press, Ames, IA. P. 701–705.
52. Rinehart C.L, Rosenberger J.K. Efectele reovirusurilor aviare asupra răspunsurilor imune ale găinilor // Poultry Sci., 1983. 62:1488–1489.
53. Ritchie A.E., Desmukh D.R., Larsen C.T., Pomeroy B.S.. Microscopia electronică a particulelor asemănătoare coronavirusului, caracteristice bolii curcanului bluecomb // Avian Dis., 1973. 17: 546–558.
54 Rosenberger J.K., N.O. Olson. în: Bolile păsărilor de curte. a 10-a ed. 1997. Iowa State University Press, Ames, IA. P. 711–719.
55. Rosenberger J.K., Fries P.A., Cloud S.S., Wilson R.A.. Caracterizarea in vitro și in vivo a aviare, Escherichia coli. II. Factori asociați cu patogenitatea // Avian Dis., 1985. 29:1094–1107.
56. Ruff M.D., Rosenberger J.K. Concurrent infecties with reoviruses and coccidia in broilers // Avian Dis., 1985. 33: 535–544.
57. Saif L.J., Saif Y.M., Theil K.VV. Virusuri enterice la păsări de curcan diareice // Avian Dis., 1985. 29:798–811.
58. Saif Y.M, Saif L.J., Hofacre C.L., Hayhow C, Swayne D.E., Dearth R.N.. A small round virus associated with enteritis in turkey poults // Avian Dis., 1989. 34:762–764.
59. Spackman D., Gough R.E., Collins M.S. Izolarea unui agent asemănător enterovirusului din meconiul embrionilor de pui morți în coajă // Vet. Rec., 1984. 114: 216–218.
60. Swayne D.E., Radin M.J., Saif Y.M. Enteric disease in specific-pathogen-free turkey poults inoculate with a small rotund turkey-origin enteric virus // Avian Dis., 1990. 34: 683–692.
61. Theil K. W. și Y. M. Saif. Infecții legate de vârstă cu rotavirus, virus asemănător rotavirusului și rotavirus atipic la efectivele de curcani //. J.Clin. Microbiol., 1987. 25:333–337.
62. Thei K.W., Reynolds D.L., Sail Y.M. Comparația dintre tehnicile de microscopie electronică imună și eloc-troferotiparea genomului pentru detectarea rotavirusurilor de curcan și a virusurilor asemănătoare rotavirusului în conținutul intestinal // J. Clin. Microbiol., 1986. 23:695–699.
63. Tiorsen J., Weninger N., Weber L., Van Dijk C. Field trials of an immunization procedure against hemorhagic enteritis of turkeys // Avian Dis., 1982. 26:473–477.
64. Trambel D.W., Kinden D.A., Solorzano R.F., StogsdilI P.L.. Parvovirus-like enteropathy in Missouri turkeys // Avian Dis., 1982. 27:49–54.
65. V an der Heide L., Kalbac M. Tenosinovită infecțioasă (artrita virală): Influența anticorpilor materni asupra dezvoltării leziunilor de tenosinovite după infecția experimentală la puii de o zi cu virusul tenosinovitei // Avian Dis., 1975. 20:641 –648,
66. Wege H., Siddel S., V. der Meulen. Biologia și patogenia coronavirusurilor // Curr. top. microbiol. Immunol., 1982. 99: 165–200.
67. Wigand R., Bartha A., Dreizin R.S., Esche H., Ginsberg H.S., Green M., Hierholzer J.C., Kalter S.S., McFerran J.B., Pettersson U., Russell W.C., Wadell G.. Adenoviridae: al doilea raport. Intervirol. 1982. 18:169–176.
68. Wood G.VV., Nicholas R.A.J., Hebert C.N., Thornton D.H.. Comparații serologice ale reovirusurilor aviare // J. Col. Pathol. 1980. 90:29–38.
69. Yason C.V., Schat K.A.. Patogeneza infecției cu rotavirus la păsări de curcan // Avian Pathol., 1986 15:421–435.