Necesarul zilnic de grăsime
Cantitatea de grăsime din dietă este determinată de circumstanțe diferite, care includ intensitatea muncii, caracteristicile climatice, vârsta persoanei. O persoană angajată într-o muncă fizică intensă are nevoie de mai multe alimente bogate în calorii și, prin urmare, de mai multe grăsimi. Condițiile climatice din nord, care necesită cantități mari de energie termică, determină, de asemenea, o creștere a necesității de grăsimi. Cu cât este mai multă energie cheltuită pe corp, cu atât este mai mare cantitatea de grăsime necesară pentru a compensa.
Necesitatea fiziologică medie de grăsime la o persoană sănătoasă este de aproximativ 30% din aportul total de calorii. Având o muncă fizică grea și un aport caloric corespunzător, care asigură un astfel de nivel de costuri energetice, proporția de grăsime din dietă poate fi puțin mai mare - 35% din valoarea energetică totală.
Nivelul normal al aportului de grăsimi este de aproximativ 1,55 g / kg, adică 70-105 g pe zi pentru o persoană care cântărește 70 kg. Toată grăsimea conținută în dietă este luată în considerare (atât în \u200b\u200bcompoziția produselor grase, cât și în grăsimea ascunsă a tuturor celorlalte produse). Produsele grase alcătuiesc jumătate din conținutul de grăsime din dietă. A doua jumătate sunt așa-numitele grăsimi ascunse, adică grăsimile care fac parte din toate produsele. Grasimile ascunse sunt introduse in diverse produse de panificatie si cofetarie pentru a-si imbunatati gustul.
Având în vedere nevoia organismului de acizi grași polinesaturați, 30% din grăsimile consumate ar trebui să fie uleiuri vegetale și 70% grăsimi animale. La bătrânețe, este rațional să se reducă proporția de grăsime la 25% din valoarea energetică totală a dietei, care de asemenea scade. Raportul dintre grăsimile animale și vegetale la bătrânețe ar trebui schimbat la 1: 1. Același raport este acceptabil cu o creștere a colesterolului seric.
Surse alimentare de grăsime
Tabel. Surse de acizi grași nesaturați și monoinsaturați.
Tabel. Surse de acizi grași polinesaturați.
Tabel. Surse de colesterol.
|
Conținut ridicat de XC |
Conținut XC moderat |
XC scăzut |
||
|
Gălbenușuri de ou |
miel | |||
|
carne de vită | ||||
|
carne de pasăre (fără piele) | ||||
|
margarină moale | ||||
|
Margarina tare | ||||
|
Torturi, tort |
Uleiuri vegetale |
|||
|
Produse finite |
număr |
Colesterolul (mg) |
||
|
Stomacul de pui | ||||
|
Crabi, Squids | ||||
|
Miel fiert | ||||
|
Peste conserve în suc propriu | ||||
|
Pescăruș (roșu, negru) | ||||
|
Vită gătită | ||||
|
Brânză grasă 50% | ||||
|
Găini, carne întunecată (picior, spate) | ||||
|
Carne de pasăre (gâscă, rață) | ||||
|
Iepure fiert | ||||
|
Mezeluri afumate | ||||
|
Carne de porc gătită | ||||
|
Untură, leneș, perie | ||||
|
Pui, carne albă (sân cu piele) | ||||
|
Pește cu grăsimi medii (coajă de mare, pește catif, crap, hering, sturion) | ||||
|
Brânză de caș | ||||
|
Brânză cremă și brânzeturi sărate (brânză feta etc.) | ||||
|
creveți | ||||
|
Carnati gatiti | ||||
|
Cascaval gras 18% | ||||
|
Inghetata Sundae | ||||
|
Inghetata cremoasa | ||||
|
Ciorba 9% | ||||
|
Inghetata de lapte | ||||
|
Brânză de căsuță fără grăsimi | ||||
|
Ouă (gălbenuș) | ||||
|
Lapte 6%, lapte copt fermentat | ||||
|
Lapte 3%, kefir 3% | ||||
|
Kefir 1%, lapte 1% | ||||
|
Grăsime de kefir., Grăsime din lapte. | ||||
|
Crema acru 30% |
1/2 cana | |||
|
Crema acru 20% |
1/2 cana | |||
|
unt | ||||
|
Crema acru 30% | ||||
|
Laptele condensat | ||||
Digestia grasimilor
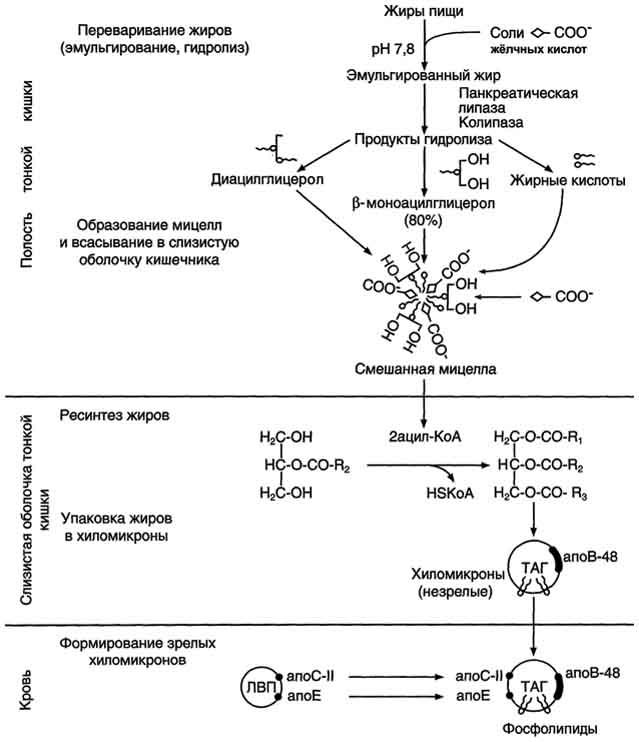
Enzimele care descompun grăsimile sunt lipaze. Efectul asupra grăsimilor lipazelor devine posibil după emulsionarea grăsimilor, deoarece lipidele sunt insolubile în apă și sunt expuse la enzime lipolitice numai la limita de fază și, prin urmare, rata de digestie depinde de suprafața. Când emulsionează grăsimile, suprafața lor totală crește, ceea ce îmbunătățește contactul grăsimii cu lipaza și accelerează hidroliza acesteia. În organism, emulgatorii principali sunt sărurile biliare.
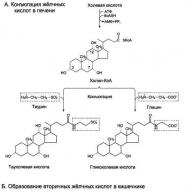
Sinteza acizilor biliari are loc pe membranele EPS ale hepatocitelor sub acțiunea hidroxilazelor (citocromele, care includ citocromul P 450), care catalizează includerea grupărilor hidroxil în poziția 7 α, 12 α, urmată de scurtarea radicalului lateral în poziția 17 cu oxidarea sa la o grupare carboxilică, de unde vine numele - acizii biliari.
Fig. Sinteza și conjugarea acizilor biliari.
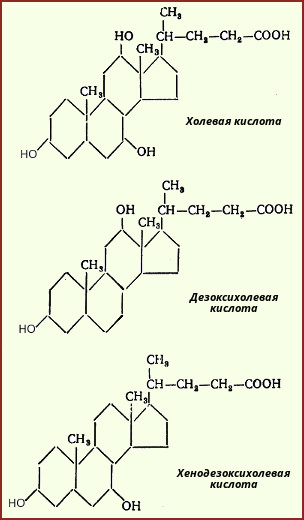
Acizii colici și chenodeoxihici formați în ficat sunt numiți acizi biliari primari. Acestea sunt esterificate cu glicină sau taurină, dând acizi biliari perechi (sau conjugați) și sub această formă sunt secretați în bilă. Acizii biliari intră în procesul de conjugare în formă activă sub formă de derivați HS-KoA. Conjugarea acizilor biliari îi face mai amfifili și crește astfel proprietățile detergentului.
Acizii biliari sintetizați în ficat sunt secretați în vezica biliară și se acumulează în vezică biliară. Atunci când sunt luate alimente grase, celulele epiteliale endocrine din intestinul subțire produc hormonul colecistokininei, care stimulează contracția vezicii biliare, iar vezica este turnată în intestinul subțire, emulsionează grăsimile și asigură digestia și absorbția lor.
Când acizii biliari primari ajung în părțile inferioare ale intestinului subțire, aceștia sunt expuși la enzime bacteriene care clivează mai întâi glicina și taurina și apoi îndepărtează grupa 7a-hidroxil. Astfel, se formează acizii biliari secundari: deoxiholic și litocolic.
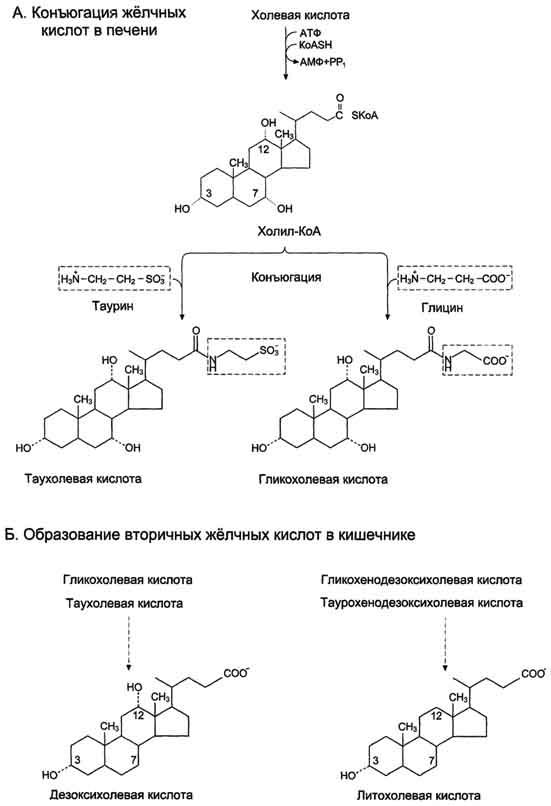
Fig. A. Conjugarea acizilor biliari în ficat. B. Formarea acizilor biliari secundari în intestin.
Aproximativ 95% din acizii biliari sunt absorbiți în ileon și prin venă portală revin la ficat, unde sunt din nou conjugate cu taurină și glicină și secretate în bilă. Drept urmare, acizii biliari primari și secundari se găsesc în bilă. Toată această cale este numită circulația enterohepatică a acizilor biliari. Fiecare moleculă de acid biliar suferă 5-8 cicluri pe zi, iar aproximativ 5% din acizii biliari sunt excretați în fecale.
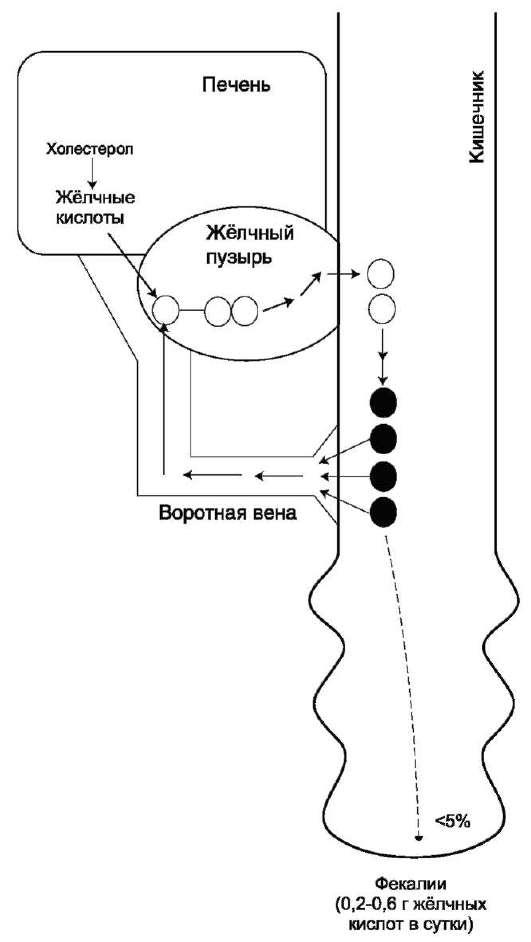
Fig. Circulația enterohepatică a acizilor biliari.
Acizii biliari formează săruri Na și K, care sunt principalii emulgatori ai grăsimilor (înconjoară o picătură de grăsime și contribuie la fragmentarea acesteia în multe picături mici), făcându-le disponibile pentru acțiunea lipazelor conținute în sucul pancreatic.
Caracteristici de acțiune
Lipasa linguală
Găsit la sugari. Catalizează descompunerea trigliceridelor emulsificate din lapte matern în stomac. La adulți, este nesemnificativ.
Sucul gastric
Lipasa linguală
2. lipaza gastrică
Ca parte a alimentelor lichide (laptele matern) primite din cavitatea bucală. Catalizează defalcarea trigliceridelor din laptele matern emulsionat. La adulți, este nesemnificativ.
Catalizează descompunerea trigliceridelor emulsionate
Sucul pancreatic
1. lipaza pancreatică
2.Kolipaza
3. lipaza monogliceridă
4. Fosfolipază A, lecitinaza
5. Colesterol esteraza
În cavitatea intestinului subțire catalizează descompunerea trigliceridelor emulsionate prin bilă. Ca urmare a hidrolizei, mai întâi se formează 1,2 și 2,3-digliceride, apoi 2-monogliceride. Dintr-o moleculă de trigliceride se formează două molecule de acizi grași. Poate fi adsorbită în glicocalixul marginii de perie a enterocitelor și poate participa la digestia membranei.
În interacțiune cu lipaza, catalizează clivajul trigliceridelor. Ca urmare a hidrolizei, se formează acizi grași, glicerină și monogliceride.
Este adsorbită în glicocalixul marginii periei de enterocite și este implicată în digestia membranei. Catalizează hidroliza 2-monogliceridei. Ca urmare a hidrolizei, se formează glicerina și acidul gras.
Catalizează descompunerea lecitinei. Ca urmare a hidrolizei, se formează digliceridă și fosfat de colină.
Catalizează clivajul esterilor de colesterol. Ca urmare a hidrolizei, se formează colesterolul și acidul gras.
Nu a fost detectat
Enzimele lipolitice prezintă activitate maximă la pH \u003d 7,8-8,2.
La un adult, în cavitatea bucală, grăsimile nu suferă modificări chimice din cauza absenței enzimelor lipolitice.
Departamentul în care se digeră cea mai mare parte a lipidelor este intestinul subțire, unde există un mediu ușor alcalin care este optim pentru activitatea lipazei. Neutralizarea acidului clorhidric din alimente este realizată de bicarbonatele conținute în sucurile pancreatice și intestinale:
HCl + NaHCO 3 → NaCl + H2 CO 3
Apoi, dioxidul de carbon este eliberat, care spume alimentele și contribuie la procesul de emulsionare.
H + + HCO 3 - → H 2 CO 3 → H2 O + CO 2.
Lipasa pancreatică este excretată în duoden sub forma unei proenzime inactive - prolipază. Activarea prolipazei într-o lipază activă are loc sub acțiunea acizilor biliari și a unei alte enzime a sucului pancreatic - colipază.
Colipază intră în cavitatea intestinală într-o formă inactivă, iar prin proteoliză parțială sub acțiunea trypsinei se transformă într-o formă activă. Domeniul hidrofob al Kolipazei se leagă de suprafața grăsimii emulsionate. O altă parte a moleculei colipazei contribuie la formarea unei astfel de configurații a moleculei de lipază pancreatică, în care centrul activ al enzimei este cât mai aproape posibil de moleculele de grăsime, prin urmare, rata reacției de hidroliză crește brusc.
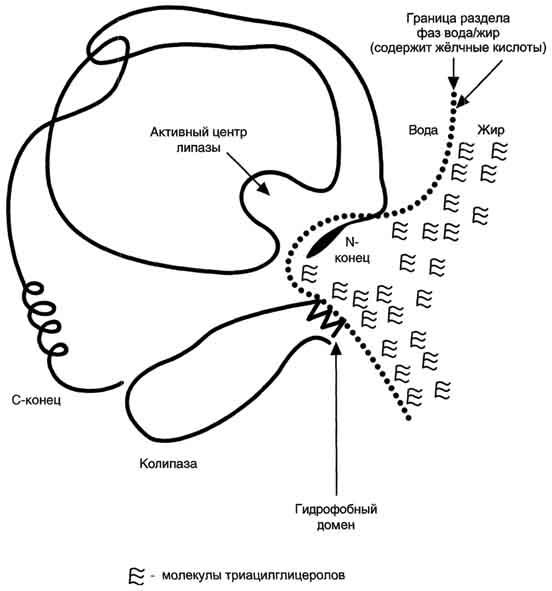
Fig. Acțiunea lipazei pancreatice.
Lipasa pancreatică este o hidrolază care scindă acizii grași din poziția α a unei molecule cu viteză mare; prin urmare, principalele produse ale hidrolizei TAG sunt 2-MAG și acizii grași.
O caracteristică a lipazei pancreatice este aceea că acționează în etape: mai întâi scindează un acid gras ridicat în poziția α, iar DAG se formează din TAG, apoi scindează al doilea acid gras ridicat în poziția α, iar 2-MAG se formează din DAG.
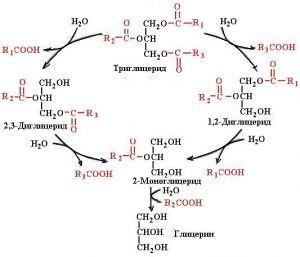
Fig. Scindarea TAG de lipaza pancreatică.
Caracteristici ale digestiei TAG la sugari
La sugari și copii mici, principalul aliment este laptele. Laptele conține grăsimi, care cuprind în principal acizi grași cu lanț scurt și mediu (4-12 atomi de carbon). Grăsimile din lapte sunt deja sub formă emulsionată, deci sunt disponibile imediat pentru hidroliză de către enzime. Lipasa, care este sintetizată în glandele limbii (lipaza limbii), acționează asupra grăsimilor din lapte din stomacul copiilor.
În plus, lipaza gastrică este produsă în stomacul sugarilor și copiilor mici, care este activ la o valoare neutră de pH caracteristică sucului gastric al copiilor. Această lipază hidrolizează grăsimile, eliminând în principal acizii grași din cel de-al treilea atom de carbon al glicerolului. Mai departe, hidroliza grăsimii din lapte continuă în intestin sub acțiunea lipazei pancreatice. Acizii grași cu lanț scurt, precum cei solubili în apă, sunt parțial absorbiți deja în stomac. Acizii grași rămași sunt absorbiți în intestinul subțire.
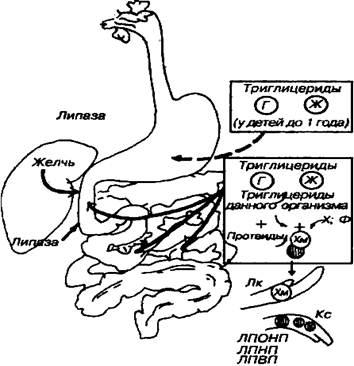
Fig. Digestia grăsimilor din tractul digestiv.
Digestia fosfolipidelor
Mai multe enzime sintetizate în pancreas sunt implicate în digestia fosfolipidelor: fosfolipază A1, A2, C și D.
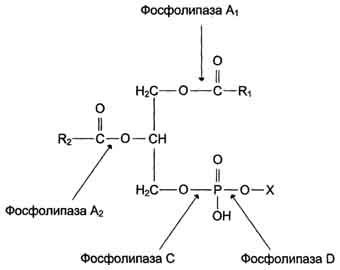
Fig. Acțiunea fosfolipazelor.
În intestin, fosfolipidele sunt clivate în primul rând folosind fosfolipază A2, care catalizează hidroliza legăturii esterice în poziția 2, cu formarea lizofosfolipidului și a acidului gras.
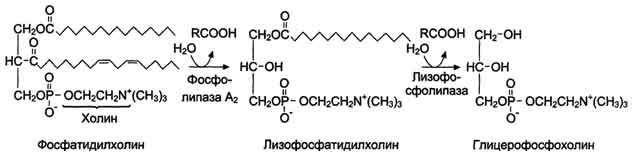
Fig. Formarea glicerofoscocolinei sub acțiunea fosfolipazelor.
Fosfolipasa A2 este secretată sub formă de profosfolipază inactivă, care este activată în intestinul subțire prin proteoliză parțială cu tripsină. Coenzima fosfolipazei A2 este Ca 2+.
Ulterior, lizofosfolipida este expusă fosfolipazei A1, care catalizează hidroliza legăturii ester în 1 poziție, cu formarea de glicerofosfatidil legat la un reziduu care conține azot (serină, etanolamină, colină), care
1) fie scindate prin acțiunea fosfolipazelor C și D la glicerol, H 3 PO 4 și baze de azot (colină, etanolamină etc.)
2) fie rămâne un glicerolfolipid (fosfolipazele C și D nu funcționează) și este inclus în micelele.
Digestia esterilor de colesterol
În compoziția alimentelor, colesterolul se prezintă mai ales sub formă de esteri. Hidroliza esterilor de colesterol are loc sub influența esterazei colesterolului - o enzimă care este sintetizată și în pancreas și secretată în intestin.
Colesterola esteraza este produsă în stare inactivă și este activată de trypsină și Ca2+. Produsele de hidroliză (colesterolul și acizii grași) sunt absorbite ca parte a micelelor mixte.
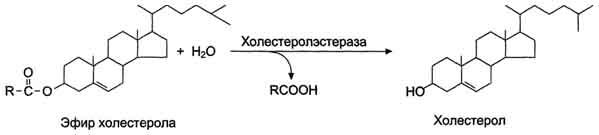
Fig. Hidroliza esterilor de colesterol sub acțiunea colesterolului esterază.
Formarea Micelle
Glicerina solubilă în apă, H 3 PO 4, acizi grași cu mai puțin de 10 atomi de carbon, substanțe care conțin azot sunt absorbite în mod difuz în vena portală.
Produsele de hidroliză rămase formează o micelă, care constă din 2 părți: intern - nucleu, care include colesterolul, acizii grași cu mai mult de 10 atomi de carbon, MAG, vitamine solubile în grăsimi și exterior- coaja exterioară, care include săruri de acizi biliari. Sărurile biliare cu o grupă hidrofobă sunt întoarse în interiorul micelei și hidrofile - spre exterior, către dipolii de apă.
Stabilitatea micelelor este asigurată în principal de sărurile biliare. Micelele se apropie de marginea periei de celulele membranei mucoase a intestinului subțire, iar componentele lipidice ale micelelor se difuzează prin membrane în celule. Împreună cu produsele de hidroliză lipidică sunt absorbite vitaminele A, D, E, K și solubile biliare solubile în grăsimi.
Absorbția acizilor grași cu lanț mediu, formați, de exemplu, în timpul digestiei lipidelor din lapte, are loc fără participarea micelelor mixte. Acești acizi grași din celulele mucoasei intestinului subțire intră în fluxul sanguin, se leagă de albumină și sunt transportate la ficat.
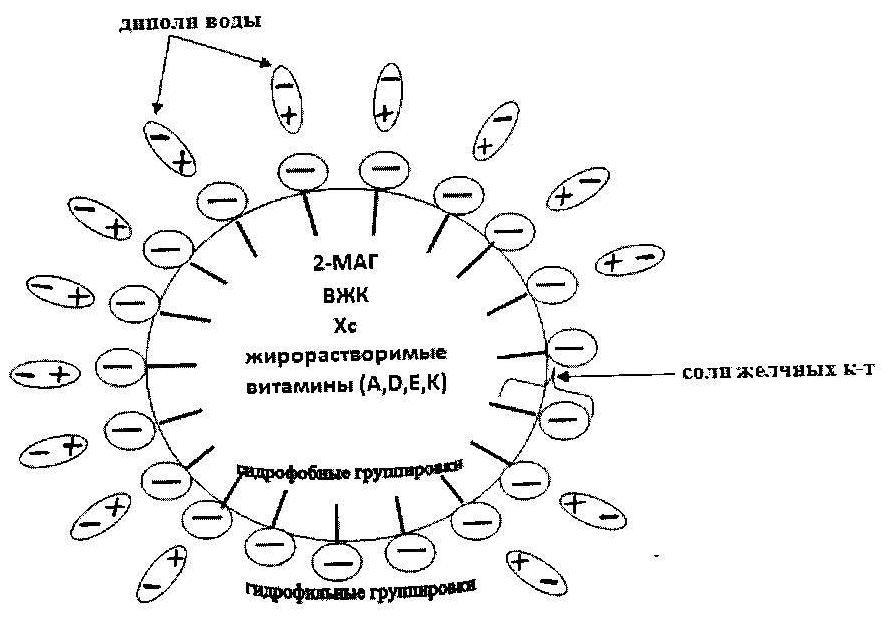
Fig. Structura micellei.
Micelele de sare biliară funcționează ca intermediari de transport pentru transferul monogliceridelor și acizilor grași liberi la bordura periei epiteliului intestinal, în caz contrar, monogliceridele și acizii grași liberi vor fi insolubili. Aici, monogliceridele și acizii grași liberi sunt absorbiți în sânge, iar sărurile biliare sunt eliberate din nou în cimă pentru a fi refolosite pentru procesul de transfer.
Resinteza grăsimilor din membrana mucoasă a intestinului subțire
După absorbția produselor hidrolizei grase, acizii grași și 2-monoacilglicerolii din celulele membranei mucoase ale intestinului subțire sunt incluși în procesul de resinteză cu formarea de triacilgliceroli. Acizii grași intră în reacția de esterificare numai sub forma activă sub formă de derivați ai coenzimei A, prin urmare, prima etapă a resintezei de grăsimi este reacția de activare a acizilor grași:
HS CoA + RCOOH + ATP → R-CO ~ CoA + AMP + H 4 P 2 O 7.
Reacția este catalizată de enzima acil-CoA sintaza (tiokinază). Apoi, acil ~ CoA este implicat în esterificarea 2-monoacilglicerolului cu formarea mai întâi diacilglicerol și apoi triacilglicerol. Reacțiile de resinteză grasă catalizează aciltransferazele.
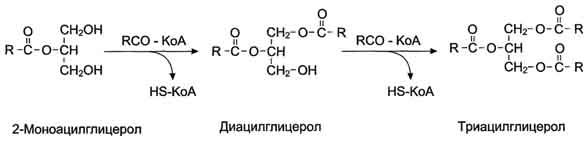
Fig. Formarea TAG din 2-MAG.
De regulă, în reacțiile de resinteză a grăsimilor sunt implicați numai acizii grași cu un lanț lung de hidrocarburi. În resinteza grăsimilor, sunt implicați nu numai acizii grași absorbiți din intestin, ci și acizii grași sintetizați în organism, prin urmare, compoziția grăsimilor resintetizate diferă de grăsimile obținute din alimente. Cu toate acestea, capacitatea de a „adapta” compoziția grăsimilor alimentare la compoziția grăsimilor din corpul uman în timpul resintezei este limitată, prin urmare, atunci când sunt ingerate grăsimile cu acizi grași neobișnuiți, cum ar fi grăsimea oilor, grăsimile care conțin acizi caracteristici grăsimilor oilor (acizi grași saturați ramificați) apar în adipocite ). În celulele mucoasei intestinale are loc o sinteză activă a glicerofosfolipidelor, care sunt necesare pentru formarea structurii lipoproteinelor - transportarea lipidelor în sânge.
Pentru a scăpa rapid și eficient de grăsimea subcutanată, trebuie să știți de ce este depusă. În articol veți primi un răspuns exhaustiv la întrebarea cum să dobândiți forme elastice ale corpului.
Recent, sălile de gimnastică au fost „pline” de capacitate cu persoanele interesate să piardă în greutate cât mai curând posibil. Instructorii cu experiență oferă sfaturi pentru a-și adapta dieta și, de asemenea, sfătuiesc mai mult să facă antrenamente cardio, care contribuie la arderea grăsimilor.
La început, întregul proces este atât de fascinant încât sportivii amatori încep să facă sport cu râvnă specială. Desigur, la urma urmei, există mai ales instructori frumoși, deștepți, care sunt și mai incitați să facă sport. O privire la cifra lor - și asta este totul, te străduiești să obții aceleași rezultate. Dar, din păcate, deseori aceste vise nu se vor realiza fără o abordare „chimică”.
Unde și de ce este depozitată grăsime

Dacă întrebi orice persoană unde este grăsimea, răspunsul va fi fără echivoc - sub piele. Grăsimea este „urâtă” urât pe piele, care ar trebui să fie întotdeauna ascunsă de hainele celorlalți (cel puțin oamenii deștepți fac asta). Există, de asemenea, grăsime viscerală, adică grăsime care învelește organele interne. Cea din urmă opțiune este cea mai periculoasă pentru sănătatea umană, deoarece pe fondul acestei situații pot apărea diverse boli.
Dacă vorbim despre grăsimea care intră în corpul nostru cu alimente, atunci nu ar trebui să o eliminați din dieta dvs. La urma urmei, el, ca carbohidrații sau proteinele complexe, susține activitatea vitală a organismului. Dar trebuie să fii în măsură să alegi grăsimile și carbohidrații „potriviți” pentru tine. La urma urmei, mâncărurile grase prăjite sunt mâncare junk. Carbohidrați rapide - dulciuri, produse coapte, paste etc. t - de asemenea, nu aduc niciun efect pozitiv. Atunci de ce să le folosești?
În zilele noastre, obezitatea la oameni este deja o întâmplare frecventă. America (SUA) suferă în special de aceasta, dar țara noastră „nu pască pe spate”. În fiecare an, din ce în ce mai mult pe stradă puteți vedea oameni obezi, în special adolescenți. Toate pentru că există prea multe unități de fast-food. A venit, a luat o gustare cu o chiflă sau un hamburger, spălat cu Coca-Cola - și poți merge mai departe.
Doar grăsimile din astfel de alimente sunt literalmente depuse imediat sub piele. Dr. Atkins, care a venit și cu o dietă cu același nume, a anunțat că carbohidrații rapide sunt de vină pentru depozitele de grăsime, întrucât cresc imediat nivelul de insulină din organism. Iar acest lucru provoacă „depozitarea” grăsimilor subcutanate. Și, în consecință, cu cât mai mulți carbohidrați sunt consumați, cu atât greutatea este mai mare pe cântar.
De ce vom vorbi exact despre trigliceride? Da, pentru că grăsimea este trigliceridele, precum și acizii grași specifici. Acesta nu este doar un element, ci o întreagă clasă de elemente care sunt legate de glicerol (particula sa). La rândul său, această clasă de elemente constă din acizi grași. Dacă adâncim mai departe, încă se pot spune multe în limbajul „chimic”, dar mulți pur și simplu nu înțeleg ce este în joc. Prin urmare, explicăm cele mai importante.
Acizii grași se găsesc în cantități mari în alimentele noastre, precum și în grăsimile subcutanate. Acizii grași saturați și nesaturați există. Odată cu alimentele, numai trigliceridele intră în organism. Pentru a le digera, așa-numiții acizi biliari sunt secretați (vezica biliară îi secretă). Enzima de clivaj se numește lipază. Lipasa procesează trigliceridele în particule mici, care se transformă din nou în trigliceride după absorbție în intestinul subțire. Apoi intră în sistemul circulator cu colesterol și lipoproteine.
Unele elemente ale acizilor grași pot intra imediat în fluxul sanguin, absorbite în mușchi în timpul exercițiului fizic. De asemenea, țesuturile active (de exemplu, inima) pot stoca câțiva acizi grași pentru a le folosi rapid mai târziu la cerere. Înainte de a intra în celulele grase, particulele de trigliceride procesate „intră” mai întâi în ficat, apoi se reîncarnează din nou în trigliceride. Trigliceridele sunt din nou transformate în acizi grași de către enzima lipoproteină lipază.
Dacă insulina va fi în doze mari în organism, atunci există o acumulare de grăsimi în celulele grase și în cantități mari. Lipoproteina lipază reține grăsimea, împiedicând-o să fie energie pentru masa musculară sau pentru mușchiul inimii.
Dacă fiecare persoană a mâncat corect și a monitorizat cantitatea de calorii consumate și, de asemenea, a mâncat carbohidrați mai puțin rapide, atunci nu ar exista probleme cu obezitatea și alte afecțiuni care apar pe fondul excesului de greutate. „A scoate” grăsimea este destul de ușor, dar cum să o elimini? Cum să-ți faci corpul potrivit și puternic? Doar antrenament? Cu greu.

Mulți oameni sunt interesați de cum să scapi de grăsimea subcutanată urâtă. Pentru a pierde masa de grăsime, acțiunea anumitor hormoni este necesară pentru celulele grase. Acești hormoni sunt:
- hormon de creștere;
- glucagon;
- adrenalina;
- hormon stimulator tiroidian.
Celulele grase sunt lipocite. Grăsimea este păstrată în ele. Odată eliberată grăsimea, aceasta se descompune în elemente precum acizii grași și glicerina.
O celulă musculară are propriile mitocondrii - acizii grași ajung acolo după clivaj. Apoi sunt oxidate și eliberate cu energie. Fiecare celulă grasă are receptori. Răspund la introducerea diverșilor hormoni. De unde provin hormonii? Hormonii sunt produși de glanda pituitară, glandele endocrine.
Așadar, grăsimea este arsă sub influența factorilor externi și interni, când hormonii cu acțiune lipolitică intră în fluxul sanguin și își încep „munca”. Trecând prin sistemul circulator, hormonii afectează receptorii celulelor grase, ceea ce duce la eliberarea de acizi grași și glicerol din aceștia. Și în final, acizii grași intră în mușchi - mitocondrii - unde sunt arse.
Grăsimea poate fi arsă în două cazuri: cu înfometare prelungită sau când o persoană petrece mult timp la sală.
În primul caz, cu ore de post, este eliberat un hormon care stimulează descompunerea grăsimilor din organism. Secretează un produs chimic care acționează asupra terminațiilor nervoase. Când o persoană este plină, atunci semnalul pierderii de grăsime dispare.
Prostaglandină hormonală

Prostaglandina produce o enzimă cu celule grase care răspunde la diverse semnale din organism. Poate încetini procesul de ardere a grăsimilor, deoarece descompun monofosfatul adenosinic ciclic. Dacă AMP ciclic se descompune, grăsimea este arsă foarte lent.
Prin urmare, dacă vă înrădăcinați în această întreagă teorie, un lucru devine clar: în procesul de acumulare și ardere a grăsimilor din corp, hormonii, enzimele și tot felul de medicamente joacă un rol important. Dar să nu credeți că cu o singură pastilă puteți obține rezultatele pe care doriți să le obțineți.
Acest articol oferă doar o parte din informațiile despre acumularea / descompunerea grăsimilor din organism. Termenii sunt greu de perceput. Dar sistemul de ardere a grăsimilor este, de asemenea, un lucru destul de complicat. Un singur lucru se poate spune: trebuie să te uiți la ceea ce mănânci, să joci sport și atunci totul va fi în ordine.
Video despre arderea grăsimilor și câștigarea masei musculare:
Metabolismul grăsimilor o combinație între procesele de digestie și absorbție a grăsimilor neutre (trigliceride) și produsele de descompunere ale acestora în tractul gastro-intestinal, schimbul intermediar de grăsimi și acizi grași și eliminarea grăsimilor, precum și produsele metabolice ale acestora din organism. Conceptele „„ și „„ sunt adesea folosite ca sinonime, deoarece care fac parte din țesuturile animalelor și plantelor includ grăsimi neutre și compuși asemănători grăsimilor, combinați sub denumirea generală Lipide .
Încălcările lui J. despre. cauza sau sunt rezultatul multor afectiuni patologice. Cea mai mare parte a grăsimilor dietetice suferă divizare în secțiunile superioare ale intestinului subțire sub acțiunea lipazei sucului pancreatic. Așa-numita lipază pancreatică prezintă un efect optim la un pH de aproximativ 8,0 și descompun substraturile aflate într-o stare emulsionată (efectul său asupra substraturilor dizolvate este mult mai slab). Aceasta catalizează hidroliza (lipoliza) legăturilor eterice într-o moleculă de trigliceride, ceea ce duce la formarea a două molecule de acizi grași și β-monogliceridă. Ca produse intermediare ale lipolizei, se formează α- și β-digliceride. Sucul intestinal conține lipază, care catalizează clivajul hidrolitic al monogliceridelor și nu afectează di- și. Cu toate acestea, activitatea sa este scăzută, prin urmare, principalele produse formate în intestin în timpul descompunerii grăsimilor alimentare sunt acizii grași și β-monogliceridele. Absorbția grăsimilor, ca și alte lipide, are loc în partea proximală a intestinului subțire. Grasimile fin emulsionate pot patrunde partial in peretele intestinal fara hidroliza prealabila. Factorul limitativ al acestui proces, se pare, este mărimea picăturilor emulsiei de grăsime, al căror diametru nu trebuie să depășească 0,5 m. Cu toate acestea, cea mai mare parte a grăsimii este absorbită numai după descompunerea sa de către lipaza pancreatică în acizi grași și monogliceride. Absorbția acestor compuși are loc cu participarea bilei (bilă) .
Acizii grași și monogliceridele formează micele grase cu componente biliare, care pot lega cantități suplimentare de colesterol neesterificat a ,
precum și solubile în grăsimi (A, D, E și K), micelele grase sunt considerate un fel de complex de lipide și produsele de descompunere a acestora cu acizi biliari și alte componente ale bilei din intestin. asigurând solubilitatea lipidelor și produsele de descompunere ale acestora în mediul acvatic (așa-numita solubilizare micelară a lipidelor) și absorbția acestora de peretele intestinal. O importanță crucială în acest caz este circulația hepatobiliară a acizilor biliari, care asigură absorbția unor cantități mari de acizi grași și monogliceride (50-70, și uneori mai mult de 100 g) cu o cantitate totală relativ redusă de acizi biliari în organism (2,8-3,5 g). Cantități mici de glicerol format în timpul digestiei grăsimilor sunt ușor absorbite în intestinul subțire. Parțial glicerolul este transformat în α-glicerofosfat în celulele epiteliului intestinal, intră parțial în fluxul sanguin. Acizii grași cu lanț scurt (mai puțin de 10 atomi de carbon) sunt, de asemenea, ușor absorbiți în intestin și intră în ocolirea oricărei transformări în peretele intestinal. În reticulul endoplasmatic se păstrează acizii grași liberi și monogliceridele care au pătruns în citoplasma celulelor epiteliale ale mucoasei intestinului subțire. Aici formează o formă metabolică activă - A-acilată - acil-CoA (vezi Coenzime) și monogliceridele sunt acilate cu formarea mai întâi digliceride și apoi trigliceride. Astfel, produsele pentru descompunerea grăsimilor alimentare care se formează în intestin și intră în peretele său sunt utilizate pentru resinteza trigliceridelor. Sensul biologic al acestui proces este că în peretele intestinal sunt sintetizate grăsimile care sunt specifice pentru oameni și diferă calitativ de grăsimile comestibile. Cu toate acestea, capacitatea corpului de a sintetiza în celulele grăsimii intestinale specifice acestui organism este limitată. În depozitele de grăsimi, grăsimile străine pot fi depuse și atunci când sunt crescute în organism. În ceea ce privește grăsimea depusă sau care intră în celulele altor organe și țesuturi, compoziția sa este foarte specifică pentru specii și este puțin dependentă de tipul de grăsime dietetică. Mecanismul resintezei trigliceridelor din celulele peretelui intestinal este larg identic cu biosinteza lor din alte țesuturi. Trigliceridele re-sintetizate în celulele peretelui intestinal, precum și cele care intră în celule din intestin, se unesc în cisternele reticulului endoplasmic neted cu o cantitate mică de proteine \u200b\u200bși formează chilomicroni - particule relativ stabile (vezi Lipoproteinele) .
Chilomicronii conțin aproximativ 2% proteine, 84-87% trigliceride, 4-7% fosfolipide și 2-5% colesterol. Mărimea particulelor chilomicronilor este cuprinsă între 120 și 1100 nm. Chilomicronii nu sunt capabili să pătrundă în vasele de sânge și să difuzeze în vasele limfatice ale intestinului și de acolo în canalul sternal, din care intră în fluxul sanguin. După 2 h după consumarea alimentelor care conțin grăsimi, se dezvoltă așa-numitul alimentar, caracterizat printr-o creștere a concentrației de trigliceride în sânge și apariția chilomicronilor în el. După ce a mâncat alimente prea grase, el ia lapte, ceea ce se explică prin prezența unui număr mare de chilomicroni în el. Vârful hiperlipemiei alimentare se observă după 4-6 h după consumul de alimente grase și după 10-12 h conținutul de grăsimi serice revine la normal, adică este 0,55-1,65 mmol / l, sau 50-150 mg/100 ml. În același timp, la persoanele sănătoase, chomomicronii dispar complet din plasma sanguină. Prin urmare, prelevarea de sânge pentru cercetări în general, și în special pentru a determina conținutul de lipide din el, trebuie efectuată pe stomacul gol, după 14 h după ultima masă. J. intermediar despre. include următoarele procese: mobilizarea acizilor grași din depozitele de grăsimi și oxidarea acestora, acizii grași și trigliceridele și conversia acizilor grași nesaturați. Țesutul adipos uman conține o cantitate mare de grăsimi, în principal sub formă de trigliceride. care îndeplinesc aceeași funcție în metabolismul grăsimilor ca ficatul în metabolismul carbohidraților (vezi. Metabolizarea carbohidraților) .
Stocurile de trigliceride pot fi consumate în timpul postului, munca fizică și alte condiții care necesită multă energie. Stocurile acestor substanțe se reumple după ce mâncați mâncare. o persoană sănătoasă conține aproximativ 15 kgtrigliceride (140.000 kcal) și numai 0,35 kgglicogen (1410 kcal). Trigliceride de țesut adipos cu o necesitate medie de energie pentru adulți de 3.500 kcal pe zi, teoretic suficient pentru a oferi organismului necesarul de energie de 40 de zile. Trigliceridele țesutului adipos se supun hidrolizei (lipolizei) sub acțiunea enzimelor lipază. Țesutul adipos conține mai multe lipaze, dintre care așa-numita lipază hormon-sensibilă (triglicerida lipază), lipaza digliceridă și lipaza monogliceridă au cea mai mare importanță. Lipasa sensibilă la hormoni este într-o formă inactivă în țesutul adipos și este activată sub influența AMP ciclic 3 ", 5" -AMP. Când trigliceridele sunt activate în mod complex de trigliceride, iar apoi produsele intermediare ale lipolizei - di- și monogliceride-lipaze formează în cele din urmă glicerol și NEFA. care provin din țesutul adipos (glicerina - în formă liberă, NEFA - sub forma unui complex cu albumină plasmatică din sânge). Soarta NEZHK în țesutul adipos în sine depinde în mare măsură de conținutul de glucoză din acesta sau, mai precis, de intensitatea glicolizei care se desfășoară în ea .
Aceasta se explică prin faptul că fosfatul de diacetonă format în timpul glicolizei este parțial redus la α-glicerofosfat, care la rândul său reacționează cu acizii grași, ca urmare a cărora se formează din nou trigliceride. Trigliceridele resintetizate rămân în țesutul adipos, contribuind astfel la menținerea rezervelor sale totale. În timpul postului, când conținutul de glucoză din țesutul adipos este scăzut, NEFA eliberat în timpul lipolizei nu poate fi utilizat de țesutul adipos pentru resinteza trigliceridelor și, prin urmare, părăsesc rapid acest țesut. Astfel, activarea glicolizei în țesutul adipos este un factor care contribuie la acumularea trigliceridelor în ea, iar inhibiția glicolizei, dimpotrivă, contribuie la îndepărtarea acestora. Creșterea lipolizei în țesutul adipos este însoțită de o creștere a concentrației de acizi grași liberi din sânge. Complexul din zer - acizi grași liberi este format din 99% proteine \u200b\u200bși doar 1% din acizi grași. În ciuda acestui fapt, transportul acizilor grași este foarte intens: de la 50 la 150 sunt transferați în corpul uman pe zi gacizi grași. Aceasta se explică prin rata mare de reînnoire a albuminei serice complexe - acizi grași (timpul de înjumătățire plasmatică este de aproximativ 5 min). Acizii grași legați de albumină cu flux de sânge intră în organe și țesuturi, unde suferă oxidare β și apoi oxidare în ciclul acidului tricarboxilic (vezi respirația țesuturilor) .
aproximativ 30% din acizii grași sunt reținuți în ficat chiar și după o singură trecere a sângelui prin el. O anumită cantitate de acizi grași care nu sunt folosiți pentru sinteza trigliceridelor este oxidată în ficat la cetonă (corpuri cetonice) .
Corpurile cetonice, fără a suferi alte transformări în ficat, intră în fluxul sanguin către alte organe și țesuturi (cum ar fi inima etc.), unde sunt oxidate la CO 2 și H2 O. O mică parte din acizii grași mobilizați este utilizată în diferite țesuturi pentru esterificarea colesterolului, sinteza fosfolipidelor, sfingolipidelor și a altor compuși. Trigliceridele sunt sintetizate în multe organe și țesuturi, dar peretele intestinal și țesutul adipos joacă cel mai important rol în această privință. Calea de biosinteză a trigliceridelor trece prin formarea de α-glicerofosfat ca intermediar. La un moment dat, acidul fosfatidic, care mai târziu a fost găsit în multe țesuturi, a fost considerat un intermediar ipotetic în biosinteza trigliceridelor și fosfolipidelor. În ficat, de exemplu, reprezintă aproximativ 1% din totalul fosfolipidelor. Acidul fosfatidic este transformat în α, β-digliceridă, care este aproape principalul substrat pentru sinteza trigliceridelor și fosfolipidelor în majoritatea organelor și țesuturilor, cu excepția peretelui intestinal. Cea finală se realizează prin interacțiunea digliceridei cu acidul gras activat (acil-CoA). Monogliceridele sunt utilizate în peretele intestinal pentru resinteza trigliceridelor, în cantități mari care provin din intestin după descompunerea grăsimilor alimentare. În acest caz, reacțiile sunt efectuate în următoarea secvență: monogliceridă + acid gras acil-CoA → digliceridă; digliceridă + acid gras acil-CoA → trigliceridă. În mod normal, cantitatea de trigliceride și acizi grași eliberați de corpul uman neschimbat nu depășește 5% din cantitatea de grăsime luată cu alimente. Practic, eliminarea grăsimilor și acizilor grași are loc prin piele cu secretele glandelor sebacee și sudoripare. Secreția glandelor sudoripare conține în principal acizi grași solubili în apă cu lanț scurt; secreția glandelor sebacee este dominată de grăsimi neutre, esteri de colesterol cu \u200b\u200bacizi grași mai mari și acizi grași liberi superiori, a căror ranciditate provoacă o neplăcere a acestor secrete. O cantitate mică de grăsime este eliberată ca parte a celulelor epidermice respinse. Cu boli de piele însoțite de o secreție crescută a glandelor sebacee (psoriazis etc.) sau o keratinizare crescută și descuamarea celulelor epiteliale, excreția de acizi grași și acizi grași din piele este semnificativ crescută. În timpul digestiei grăsimilor din tractul gastro-intestinal, sunt absorbite aproximativ 98% din acizii grași care alcătuiesc grăsimile alimentare și aproape toată glicerolul format. Cantitatea mică rămasă de acizi grași este excretată în materiile fecale nemodificată sau este transformată sub influența florei microbiene a intestinului. În general, aproximativ 5 sunt eliberați pe zi la o persoană cu fecale. g acizii grași și nu mai puțin de jumătate dintre ei au o origine complet microbiană. O cantitate mică de acizi grași cu lanț scurt (acetic, butiric, valerianic), precum și acizi β-hidroxibutirici și acetoacetici sunt eliberați în urină, a căror cantitate în urină zilnică este de la 3 la 15 mg. Apariția acizilor grași mai mari în urină se observă cu nefroza lipoidă, fracturi ale oaselor tubulare, cu boli ale tractului urinar însoțite de descuamarea crescută a epiteliului și în condiții asociate cu apariția albuminei în urină (). Reglarea metabolismului grăsimilor este realizată de c.n.s., în special de hipotalamus, care se manifestă deja în stadiul de descompunere și absorbție a grăsimilor din tractul gastro-intestinal. secțiuni ale tractului gastro-intestinal, precum și starea de anestezie încetinesc descompunerea și absorbția grăsimilor. Efect neurohormonal asupra lui J. despre. Este legat, în primul rând, de reglarea procesului de mobilizare a acizilor grași din depozitele de grăsimi. Se știe că, cu stresuri emoționale în sânge, conținutul de NEFA crește (în mod normal, NEFA în plasma de sânge este de 400-800 μmol / l), care se explică printr-o creștere accentuată a eliberării catecolaminelor în sânge (catecolamine) ,
activarea lipolizei și eliberarea de NEFA. Prin urmare, o durată îndelungată poate cauza o pierdere în greutate vizibilă. Prin activarea sau inhibarea lipolizei, un efect asupra f. și mulți alți hormoni - glucocorticoizi, glucagon, hormoni tiroidieni etc., precum și influența diferitelor afecțiuni ale corpului este realizată (răcire etc.). O creștere a concentrației de glucoză în țesutul adipos și o creștere a ratei glicolizei inhibă lipoliza. Concentrația crescută a glicemiei stimulează secreția de insulină a ,
ceea ce duce la inhibarea lipolizei. Astfel, atunci când o cantitate suficientă de carbohidrați intră în organism și rata lor de clivaj este mare, mobilizarea NEFA și oxidarea lor se desfășoară într-un ritm redus. De îndată ce rezervele de carbohidrați s-au epuizat și intensitatea glicolizei scade, lipoliza se intensifică, în urma căreia țesuturile primesc cantități crescute de acizi grași pentru oxidare. Cu toate acestea, o creștere a conținutului de acizi grași cu lanț lung în sânge determină o scădere a intensității de utilizare și oxidare a glucozei, de exemplu, în mușchi. Toate acestea indică faptul că schimburile de grăsimi și carbohidrați, care sunt principalele procese de formare a energiei în corpul animalului, sunt atât de strâns legate între ele, încât mulți factori care afectează un metabolism direct sau indirect afectează celălalt. Glanda tiroidă are un efect de activare asupra oxidării acizilor grași, în timp ce are un efect stimulant asupra grăsimilor din carbohidrați. Hiperfuncția glandei tiroide duce la scăderea depozitelor de grăsimi și este adesea însoțită de obezitate. determină, de asemenea, depunerea excesivă de grăsime. De mare importanță pentru statul Zh. are putere (putere) .
Consumul excesiv pe termen lung de alimente bogate în grăsimi și carbohidrați duce la o depunere semnificativă de grăsime în organism. Cu o lipsă de substanțe lipotrope din alimente, în special fosfolipide sau substanțele care le compun (colină, inozitol), precum și metionină, există o depunere excesivă de grăsime în ficat (dezvoltarea așa-numitului ficat gras), ceea ce este cel mai probabil datorită faptului că în absența fosfolipidele ficatului nu pot utiliza trigliceridele pentru a forma lipoproteine. O substanță a fost descoperită în pancreas a cărei administrare împiedică apariția unui „ficat gras”. Tulburări ale metabolismului grăsimilor. Unul dintre motivele absorbției insuficiente a grăsimilor în intestinul subțire poate fi împărțirea incompletă a acestora, fie datorită scăderii secreției de suc pancreatic (lipsa lipazei pancreatice), fie datorită scăderii secreției de bilă (lipsa acizilor biliari necesari pentru emulsificarea grăsimii și formarea micelelor grase). O altă cauză, cea mai frecventă, a absorbției insuficiente a grăsimilor în intestin este o încălcare a funcției epiteliului intestinal, observată cu enterită, hipovitaminoză, hipocorticism și alte alte condiții patologice. În acest caz, monogliceridele și acizii grași nu pot fi absorbiți în mod normal în intestin din cauza epiteliului său. Absorbția deteriorată a grăsimilor este observată și cu pancreatită, icter obstructiv, după rezecția subtotală a intestinului subțire, precum și vagotomie, ceea ce duce la scăderea tonusului vezicii biliare și a încetinit fluxul de bilă în intestin. Absorbția redusă a grăsimilor se observă cu hipogammaglobulinemia, boala Whipple (boala Whipple) ,
boală prin radiații (boală cu radiații) .
Absorbția deteriorată a grăsimilor în intestinul subțire duce la apariția unei cantități mari de grăsimi și acizi grași în fecale - steatorree. Cu o încălcare prelungită a absorbției de grăsimi, organismul primește, de asemenea, o cantitate insuficientă de vitamine solubile în grăsimi. Cu activitatea redusă a lipoproteinei lipazei, tranziția acizilor grași de la chilomicroni și lipoproteine \u200b\u200bcu densitate mică (pre-β-lipoproteine) ale plasmei sanguine la depozitele de grăsimi este perturbată. Cel mai brusc, această încălcare se manifestă în hiperlipoproteinemia de tip I (conform clasificării Fredrickson). Această hiperlipoproteinemie, denumită și lipemie indusă de grăsime sau hipercilomicronemie, se caracterizează prin faptul că, din cauza absenței complete a activității ereditare a lipoproteinei lipazei, trigliceridele plasmatice din sânge nu pot suferi clivaj și se acumulează în sânge. în astfel de cazuri, are o culoare lăptoasă, datorită conținutului extrem de ridicat de chilomicroni, iar atunci când stă, apare un strat cremos de chilomicroni. Cea mai eficientă a acestei patologii este înlocuirea în dieta grăsimilor naturale cu cele sintetice care conțin acizi grași cu lanț scurt cu 8-10 atomi de carbon din lanțul de carbon care sunt absorbiți din intestin direct în sânge fără formarea preliminară a chilomicronilor. În hiperlipoproteinemia de tip V, numită și hiperlipemie mixtă, datorită activității reduse a lipoproteinei lipazei în sânge împreună cu chilomicronii acumulează densitate mică. În aceste cazuri, administrarea intravenoasă de heparină, care este un activator al lipoproteinei lipazei, duce la iluminarea plasmei din sânge (cu hiperlipoproteinemie de tip I, heparina nu dă efect). Pacienților li se recomandă o dietă săracă în grăsimi și săracă în carbohidrați. Dacă transformarea pre-β-lipoproteinelor în β-lipoproteine \u200b\u200beste perturbată, β-lipoproteinele „flotante” patologice (hiperlipoproteinemia de tip III) se acumulează în sânge. Acești pacienți se caracterizează printr-o scădere a carbohidraților: o încărcătură de carbohidrați duce la o creștere persistentă a conținutului de trigliceride și pre-β-lipoproteine \u200b\u200bdin sânge. O combinație frecventă a acestui tip de hiperlipoproteinemie cu diabet este caracteristică. Acumularea excesivă de grăsime în țesutul adipos este adesea observată la persoanele practic sănătoase, în special la persoanele de vârstă mijlocie și vârstnice. Motivul pentru aceasta este supraalimentarea, în care alimentele totale depășesc costurile energetice ale organismului (vezi Obezitatea) .
Depunerea excesivă de grăsime este adesea observată trei tranziții de la activitatea fizică activă la un stil de viață sedentar, atunci când primul nivel de excitabilitate al centrului alimentar și primul sunt menținute, iar cheltuielile energetice ale organismului sunt reduse semnificativ. Patologic se observă atunci când următorii factori acționează separat sau în combinație: activitate redusă a țesutului adipos în raport cu mobilizarea grăsimii și activitate crescută în raport cu depunerea de grăsime; conversia sporită a carbohidraților în grăsimi, creșterea centrului alimentar, scăderea activității musculare comparativ cu normalul. O scădere a mobilizării de grăsimi este observată în leziunile centrilor hipotalamici, când impulsurile care intră în țesutul adipos de-a lungul căilor simpatice și provoacă accelerarea lipolizei grăsimilor neutre sunt slăbite. mobilizarea grăsimilor din acel depozit are loc și atunci când slăbește funcția glandei tiroide și a glandei pituitare, ale căror hormoni (, triiodotironina și hormonul de creștere, factorul hipofizar lipomobilizant) activează lipoliza. Gonadele reduse duc la depunerea excesivă de grăsime, mai ales dacă este însoțită de o activitate afectată a glandei hipofizare, a centrelor hipotalamice și a scăderii activității musculare (vezi distrofia adiposogenitală ,
Itsenko - boala lui Cushing). Consolidarea transformării carbohidraților în grăsimi și depunerea lor în țesutul adipos are loc cu secreția crescută de ACTH, glucocorticovide și insulină. Principalul factor în dezvoltarea așa-numitei obezități ereditare-constituționale este hipersecreția de insulină. Depunerea de grăsime poate fi observată în anumite zone ale țesutului adipos, inclusiv localizate în zonele de distribuție a anumitor fibre nervoase. O astfel de depunere de grăsime sau, în schimb, țesut adipos subcutanat este asociată cu o modificare a funcției trofice a sistemului nervos (vezi Lipidoze ,
liposis ,
lipodistrofie) .
Depunerea insuficientă de grăsime în țesutul adipos () se dezvoltă datorită inhibării excitabilității centrului alimentar, absorbției scăzute a grăsimilor și carbohidraților (de exemplu, cu enterită), predominarea proceselor de mobilizare a grăsimii din țesutul adipos prin depunerea acesteia și în timpul înfometării prelungite. Încălcarea formării de grăsimi din carbohidrați poate fi observată cu leziuni ale centrelor vegetative (trofice) ale sistemului hipotalamic-hipofizar, precum și cu cortexul suprarenal. Astfel de tulburări stau la epuizarea progresivă în cachéxia hipofizară (vezi insuficiența hipotalamică-hipofizară) și boala Addison (boala Addison) .
Acumularea de grăsime în celulele ficatului este adesea o reacție a ficatului la diverse boli, efecte toxice și daune. Acumularea de grăsime în ficat are loc atunci când rata de formare a trigliceridelor depășește rata de utilizare a acestora. Ficatul gras se observă în diabetul zaharat, obezitate, deficiență de proteine, în caz de otrăvire cu alcool, tetraclorură de carbon, fosfor și în absența substanțelor lipotrope din organism. Una dintre cele mai frecvente încălcări ale lui J. despre. la oameni, cetoza este o formare crescută în organism, acumularea de corpuri cetonice în țesuturi și sânge și urină (corpuri cetonice) .
Sub acțiunea radiațiilor ionizante (radiații ionizante) în diferite țesuturi ale corpului suferă modificări pronunțate, care au caracteristici calitative și temporale, în funcție de tipul de țesut. Când sunt iradiate în mucoasa intestinului subțire, conținutul de lipoproteine, fosfolipide, acizi grași și colesterol scade, ceea ce se datorează nu numai distrugerii celulelor membranei mucoase, dar și suprimării sintezei lipidice din ele. lipazele din membrana mucoasă a intestinului subțire în timpul iradierii scad, ca urmare a reducerii intensității descompunerii grăsimilor și a absorbției trigliceridelor; absorbția acizilor grași este suprimată într-o măsură mai mică. În funcție de condițiile nutriționale, conținutul de lipide din ficat crește sau rămâne neschimbat atunci când este expus radiațiilor ionizante, dar în orice caz, sinteza așa-numitelor lipide comune și a fracțiilor lor individuale - trigliceride, fosfolipide, acizi grași și colesterol este stimulată, iar sinteza grăsimilor neutre este inhibată, cuplat cu glicoliza (sau glicogenoliza) și activarea sintezei grăsimilor din acidul acetic. În urma modificărilor, J. despre. în ficat după o reacție nespecifică la, de regulă, se dezvoltă hiperlipemia. Baza pentru dezvoltarea hiperlipemiei post-radiație nu este atât mobilizarea grăsimilor din depozitele de grăsimi periferice, cât îmbunătățirea biosintezei sale în ficat. În primele zile după iradierea țesutului adipos, se îmbunătățește sinteza lipidelor din glucoză și metaboliții săi, care este asociată cu activarea gluconeogenezei și hiperglicemiei ulterioare și cu o creștere a insulinei în sânge. La o dată ulterioară după iradiere, intensitatea sintezei de grăsime în țesutul adipos scade și este înlocuită cu mobilizarea crescută a grăsimii din depozitele de grăsimi. În țesuturile radiorezistente (rinichi, plămâni, mușchi scheletici și) modificări semnificative în J. cca. după iradiere nu are loc. Caracteristici ale metabolismului grăsimilor la copii. Ruperea hidrolitică a grăsimilor în stomac joacă un rol important în procesul de digestie la copii, în special la sugari, al căror suc gastric moderat (pH aproximativ 5,0) ajută la digerarea grăsimilor emulsificate din lapte matern cu lipază gastrică. În plus, cu utilizarea prelungită a laptelui ca principal produs alimentar la sugari, este posibilă o creștere adaptativă a sintezei lipazei gastrice. partea superioară a esofagului sugarului secretă propria lipază ca răspuns la fraieri în timpul alăptării (este posibil ca această lipază să-și exercite efectul în stomacul sugarilor). La nou-născuți, lipaza gastrică descompune numai acele grăsimi ale căror molecule includ acizi grași cu lanț scurt. Datorită imaturității relative a funcției exocrine a ficatului și a activității scăzute a lipazei pancreatice la copii (în special la nou-născuți și la copiii din primii 3 ani de viață), absorbția grăsimii (în principal, trigliceride care conțin acizi grași cu lanț lung) este mai mică decât la adulți. La nou-născuții pe termen complet, aproximativ 85-90% din grăsimea care intră în organism este absorbită, la sugarii prematuri, 60-79%. La nou-născuți, datorită coeficientului scăzut de absorbție a grăsimilor, se observă adesea. Excreția lipidelor cu fecale la un copil de 3 luni este de 3 gși, ulterior, scade la 1 gpe zi. Rolul grăsimilor în furnizarea unui copil de energie și material plastic este mai mare, cu atât este mai puțin. Una dintre sursele de energie este țesutul adipos brun și alb (regulat). Masa țesutului adipos brun la un nou-născut este de aproximativ 30 g, adică constituie aproximativ 1% din greutatea sa corporală. În perioada timpurie a nou-născutului, acest țesut ajută la menținerea temperaturii corpului datorită așa-numitei generații de căldură necontractive. Țesutul adipos alb suferă modificări legate de vârstă. Creșterea masei grase la făt până la sfârșitul perioadei de dezvoltare a fătului este asociată cu o creștere a mărimii lipocitelor (adipocite); din momentul nașterii până la 6 ani, mărimea lor crește de 3 ori. La copiii sănătoși peste 12 ani, lipocitele ating dimensiunea lipocitelor adulte, iar la copiii obezi acest lucru se întâmplă până la vârsta de 2 ani. Numărul de lipocite la copiii sănătoși se triplă cu vârsta de 3 ani, adică. în timpul primului an de viață, nu numai mărimea crește, dar și numărul de celule grase. Mai departe, până la vârsta de 16 ani, o creștere a dimensiunii lipocitelor apare mai intens. Capacitatea depozitelor de grăsime din corpul copilului ca o condiție pentru depunerea excesului de grăsime este o trăsătură moștenită. Diferențele sexuale în cantitatea de grăsime din organism sunt detectate de la o vârstă fragedă. Deci, la fetele nou-născuți, există tendința către un conținut mai mare de grăsime subcutanată. Diferențele de cantitate de grăsime subcutanată și totală la fete și băieți cresc în primii ani de viață. De la vârsta de 7 ani, depozitele de grăsime cresc atât la fete, cât și la băieți, cu toate acestea, la băieți, cantitatea de grăsime de la membre scade. Cea mai semnificativă predominanță a conținutului de grăsimi din corpul feminin în comparație cu masculul este identificată de la pubertate. Țesutul adipos la un băiat este de aproximativ 10%, iar la o fată - 20% din greutatea corporală. Caracteristicile legate de vârstă ale mecanismelor de reglare a lipolizei sunt lipocitele crescute ale copiilor mici la adrenalină și glucagon. la insulină este invers legată de mărimea lipocitelor, aceasta scade odată cu creșterea diametrului celulelor grase. Gradul de peroxidare a lipidelor la nou-născuți (vezi Peroxidare) ,
activitatea enzimelor antioxidante și conținutul de tocoferoli în sânge este mai mică decât cea a mamelor lor, cu toate acestea, la nou-născuți, raportul de tocoferoli: total este mai mare decât în \u200b\u200bsângele mamelor și în sângele placentar. Acumularea de produse de peroxidare este sporită de conținutul scăzut de tocoferoli în sânge și țesuturi, în special la copiii care sunt alăptați. Concentrația lipidelor totale în sângele cordonului nu depășește 1/3 din concentrația lor în sângele mamei. La nou-născuți, comparativ cu copiii mai mari, conținutul lor este semnificativ mai mic și se ridică la 1,7-4,5 g / l. Până la vârsta de 14 ani, concentrația lipidelor totale în sânge crește până la 4,5-7,0 g / l. Odată cu vârsta, există o creștere a raportului conținutului de NEFA și acizilor grași saturați. Concentrația de NEFA în sângele cordonului ombilical este de 2-3 ori mai mică decât în \u200b\u200bsângele mamei; la copiii mai mari, nu diferă de concentrația de NEFA în sângele adult (0,3-0,6 mmol / l), dar gama de fluctuații în concentrațiile de NEFA este mai largă. În perioada neonatală, se observă trigliceride mai mici în sânge în comparație cu alte fracții care alcătuiesc lipide totale. Concentrația de trigliceride în sângele nou-născuților este de 6 ori mai mică decât în \u200b\u200bsângele mamelor și depinde de copilul pe termen complet. Conținutul de trigliceride din sângele unui copil crește rapid și crește cu vârsta cu o medie de 50%. Concentrația fosfolipidelor în sângele nou-născuților este de 40% din conținutul lor în sânge matern, adică. medie 0,8 mmol / l. Creșterea cantității de fosfolipide din sângele bebelușului începe imediat după naștere și până la sfârșitul primului an de viață crește de 2 ori. Conținutul de lipide din sângele unui copil este supus fluctuațiilor sezoniere. În perioada de toamnă-iarnă, conținutul total de lipide este semnificativ mai mic decât în \u200b\u200bperioada de primăvară-vară, ceea ce este considerat ca urmare a utilizării lor crescute în sezonul rece. Încălcările lui J. despre. copiii au diverse forme și criterii de diagnostic. dislipidemia primară este stabilită în acele cazuri când sunt dezvăluite schimbări stabile ale unuia sau mai multor indicatori de Z. în absența altor boli. Dislipidemia familială determinată genetic se manifestă mai des doar sub influența excesului și a malnutriției, a situațiilor stresante și a altor factori adversi. Dislipidemia congenitală include astfel de încălcări ale lacului care sunt depistate la un copil încă din primele luni de viață, dar care nu au caracter ereditar sau familial și sunt cauzate de factori adversi care acționează în perioada prenatală (cronice, mamele cu zahăr, obezitatea ei, a doua jumătate a sarcinii) . Dislipidemia dobândită este rezultatul obezității, diabetului zaharat, hipotiroidismului, pancreatitei, hepatitei, colecistitei, nefritelor, bolilor difuze ale țesutului conjunctiv. Dislipidemia dobândită se dezvoltă în diferite perioade din viața postnatală a copilului. Factorii care contribuie la apariția dislipidemiei dobândite includ copii anormali și afectarea funcției gastro-intestinale. Metode de cercetare la copii la fel ca la adulți. Cel mai adesea, este investigată compoziția calitativă și cantitativă a lipidelor din sânge și a membranelor celulare. Marea enciclopedie sovietică
Sau metabolismul, baza vieții, ordinea naturală de transformare a substanțelor și a energiei în sistemele vii, care vizează conservarea și auto-reproducerea lor; totalitatea tuturor reacțiilor chimice care apar în organism. F. Engels, ... ... Marea enciclopedie sovietică
SCHIMB DE SUBSTANȚE ȘI ENERGIE - metabolismul și energia, metabolismul, totalitatea transformărilor de substanțe și energie din organism, asigurând activitatea vitală a acestuia. F. Engels, care definește viața, a subliniat că proprietatea sa cea mai importantă este un metabolism constant cu mediul ... ... Dicționar enciclopedic veterinar
Metabolizarea lipidelor - include procesele de primire, digestie, absorbția lipidelor, biosinteza lipidelor specifice, descompunerea acestora și excreția produselor finale; include grăsimi grase (neutre) și lipoide (transformarea lipoidelor) ... Glosar de fiziologie a animalelor de fermă
Partea lipidelor O. corespunzătoare etapelor de transformare a grăsimilor neutre ... Mare dicționar medical
ștergere - (latină obliteratio distrugere), termen folosit pentru a face referire la închiderea, distrugerea unei anumite cavități sau lumen prin proliferarea țesutului care vine de pe pereții unei formări a cavității date. Extinderea specificată mai des ... ...
OBEZITATE - (obezitate, obezită, adipo sitas, polisarkie, lipomatoză universalis, lipoză), o creștere a greutății corporale, comparativ cu normal, datorită depunerii excesive de grăsime în țesutul subcutanat, omentum, mediastin, etc. Dacă, ca urmare ... Enciclopedia medicală mare
FICAT - LIVER. Cuprins: I. Ashtomy al ficatului ............... 526 II. Histologia ficatului .............. 542 III. Fiziologia hepatică normală ... 548 IV. Fiziologia patologică a ficatului ..... 554 V. Anatomia patologică a ficatului ...... 565 VI ... ... Enciclopedia medicală mare
POWER - ALIMENTE. Cuprins: I. Nutriția ca social. problema igienei. Despre moartea lui P. în lumina dezvoltării istorice și a stanei societății umane ........ . 38 Problema lui P. într-o societate capitalistă 42 Producția produselor P. în Rusia țaristă și URSS ... Enciclopedia medicală mare
Corpul uman este Universul, care trăiește după propriile sale legi, adesea necunoscute minții. Are un mecanism de autoreglare excelent care este sensibil la diverse schimbări de mediu. Ea are constanța naturii naturii sale - homeostază, susținând toate sistemele într-o manieră normală. Conductorii acestei orchestre armonioase sunt hormoni care determină funcțiile fiziologice ale întregului organism, macro- și microstructura organelor și țesuturilor și rata procedeelor \u200b\u200bbiochimice. Este ușor de presupus că orice tulburări în sinteza sau descompunerea hormonilor vor duce la o schimbare a sintezei normale a enzimelor și, în consecință, la o încălcare a metabolismului - metabolism. Rădăcinile unei boli precum obezitatea se găsesc adesea în boli ale sistemului endocrin. Vorbind despre rata metabolismului grasimilor, nu putem lipsi faptul că lipoliza, ca, în general, toate procesele din organism, depinde de reglarea hormonală. Deci, „uită-te la rădăcină” - grăsimile „arde” nu din aerobic, dietă și medicamente, ci din modificările hormonale pe care le provoacă. Care sunt acești hormoni minunați care fac să ardă grăsimea ca o tigaie, cum poți acționa asupra lor, crescând rata lipolizei? Cunoscând mecanismul de ardere a grăsimilor, puteți crește eficiența acestui proces cu 50%, reducând în același timp costurile fizice. Cum se stimulează sistemul endocrin pentru sinteza hormonilor care ard arderea grăsimilor? Poate cineva va fi fericit, dar cineva se va supăra, cu toate acestea, injectarea și înghițirea acestor acești hormoni nu este necesară (deși eficientă). Există numeroase stimulente fiziologice și farmaceutice care nu sunt contra-counter, care, atunci când sunt utilizate corect, vor ajuta la începerea procesului de lipoliză și, în același timp, să mențină sănătatea. Moduri fiziologice de a stimula arderea grăsimilor
Principalul stimulator al eliberării hormonilor care ard arderea grăsimilor este stresul. O reacție la stres este un set de modificări secvențiale în organism care alcătuiesc sindromul de adaptare generală. Prima etapă este stadiul anxietății. Se caracterizează prin desfășurarea activității mecanismului de adaptare generală. O modificare tipică a funcțiilor glandelor endocrine în acest caz este producția crescută de adrenalină, norepinefrină și cortizol, de care grăsimea se teme cel mai mult. În același timp, activarea sistemului nervos simpatic (vegetativ, care conectează toate organele externe și interne) stimulează dramatic reacțiile redox, caracterizate prin descompunerea depozitelor de glicogen și prin utilizarea grăsimilor. Așa căutați-ne amiabil pe ai noștri ..., adică capul aventurii - și „brusc”. Într-adevăr, este greu să vezi alpinisti grași sau alergători auto. Cu toate acestea, în contextul realității obișnuite, o săritură cu parașuta matinală poate fi înlocuită cu o alergare de dimineață sau o saună de seară. Dar primele lucruri în primul rând ... Mecanismul de adaptare generală nespecifică, adică. stresul este cauzat de un anumit factor - un stresor. Ce stresori pot fi adoptați în lupta împotriva excesului de grăsime?
1. Antrenament de forță (modul de operare anaerobă). În acest caz, avem de-a face cu supraîncărcare fizică, care obligă organismul să pornească mecanismul de adaptare la factorul de mediu extrem. O greutate decentă a barei (în special în versiunea de bază) dă o puternică scuturare a sistemului nervos central. Sistemul nervos central aduce organismul într-o stare de stres, forțându-l să se adapteze, aruncând „ambalajul” hormonilor pentru a declanșa reacții homeostatice. Homeostazia - constanța mediului intern - este ceea ce orice organism este preocupat de-a lungul vieții. Antrenamentul de forță îl obligă să mobilizeze resursele de energie pentru a asigura activitatea musculară (defalcarea și resinteza ATP), să activeze funcțiile endocrine care controlează suportul plastic al structurilor celulare care lucrează intens, iar după ce lucrarea este finalizată, să preia procesele de recuperare. De ce hormoni avem nevoie pentru a începe arderea grăsimilor? Adrenalină, glucagon, cortizol, STH. În timpul antrenamentelor de forță, o adiere de adrenalină este inevitabilă, deoarece joacă un rol important în activarea glicogenolizei anaerobe în mușchi. Utilizarea semnificativă a glicogenului muscular este posibilă numai în prezența adrenalinei în cantități care depășesc nivelul acestuia în sânge în repaus. După 30 de minute de muncă, apare o creștere a concentrației de glucagon, care este necesară pentru stimularea suplimentară de către acest hormon de mobilizare a depozitelor de glicogen din ficat și, în final, pentru a utiliza resursele energetice rămase, apare efectul lipolitic (de ardere a grăsimii) al adrenalinei și glucagonului, care asigură mobilizarea surselor de grăsime. Cortizolul, care este produs în orice situație stresantă, îmbunătățește această acțiune.
Principalele sale funcții includ:
a. stimularea gluconeogenezei, care oferă energie suplimentară. În procesul de „activități de ardere a grăsimilor”, este deosebit de importantă această necesară și neînlocuibilă necesitate a neoplasmei glucozei din ficat din surse non-carbohidrate. Când rezervele de glicogen (depozitul de carbohidrați din corp) sunt epuizate în condițiile unei „descărcări” de carbohidrați (o dietă fără carbohidrați, care este considerată cea mai eficientă pentru arderea grăsimilor), organismul nu are de ales decât să înceapă să utilizeze niște aminoacizi (care pot fi adăugați la dietă) eliminarea posibilității de descompunere a țesutului muscular) și a grăsimilor;
b. acțiune crescută a adrenalinei;
în. stimularea catabolismului proteic pentru izolarea aminoacizilor pentru sinteza enzimelor;
d. mobilizarea crescută a acizilor grași liberi, ceea ce îi face cea mai accesibilă sursă de energie.
Așadar, nu vă grăbiți să păcătuți pe cortizol ca „hormon catabolic dăunător responsabil pentru pierderea masei musculare”. Glucocorticoizii, ca și alți hormoni, sunt importanți pentru figura noastră atât în \u200b\u200bceea ce privește creșterea mușchilor - fără ruperea proteinelor, nu va exista sinteza acestora și nici o descompunere a grăsimilor. Principalul lucru este „consimțământul inter-hormonal”. După cum se știe, insulina chiar și în concentrația normală blochează lipoliza. Scăderea acestui hormon în condițiile antrenamentului de forță apare după 10-20 de minute de muncă. Acest lucru trece energia de la carbohidrați la utilizarea de grăsimi ca substrat de oxidare în mușchii care lucrează. Toată lumea știe că antrenamentul de forță stimulează eliberarea hormonului lipolitic - hormonul de creștere. Cu toate acestea, efectul său de ardere a grăsimilor, spre deosebire de adrenalină, care stimulează lipoliza instantaneu, se manifestă la 1-2 ore după creșterea hormonului de creștere în sânge. Aceasta este o proprietate uimitoare a STH: imaginați-vă că antrenamentul s-a încheiat, vă odihniți, iar hormonul de creștere mănâncă grăsime în acest moment, sintetizând structurile proteice ale mușchilor noștri iubiți.
2. Antrenament aerobic (alergare, canotaj, bicicletă etc.). Alergarea, ca nimic altceva, activează sistemul simpatic-suprarenal, crescând eliberarea principalilor neurotransmițători - catecolaminele (L-DOPA și dopamina), care sunt sintetizate din aminoacidul fenilalanină și completează lanțul de transformări în imaginea norepinefrinei și adrenalinei. Ca urmare a acțiunii adrenalinei și norepinefrinei, transportul de oxigen la țesuturi, în special la mușchi, este îmbunătățit. Consumul de oxigen din mediu contribuie la efectul bronhodilatant al adrenalinei. Rolul adrenalinei în mobilizarea resurselor energetice (adică, descompunerea carbohidraților și grăsimilor) este că sub influența sa în mușchi, creșterea descompunerii glicogenului în mușchi este îmbunătățită. Acest lucru stimulează reacțiile redox. Eliberarea de glucoză în sânge și utilizarea acidului lactic (H + + lactat) vă permite să combateți oboseala și să lucrați mult timp în regim aerob, ceea ce este o condiție necesară pentru arderea grăsimilor. Reacții oxidative - aceasta este calea aerobă (oxigen) a descompunerii grăsimii neutre în apă și dioxid de carbon cu eliberarea a 75 de molecule de ATP: grăsime neutră + oxigen (O2) -\u003e 75ATP + CO2 + H2O. Munca de lungă durată de intensitate medie (alergare, mers cu bicicleta, canotaj) pornește calea oxidării aerobe, care, cu toată monotonia sa epuizantă, este cea mai scurtă cale de a arde grăsimea pe laturi. Cealaltă latură a rolului adrenalinei în procesul de lipoliză este efectul său lipolitic (pe lângă efectul său stimulant asupra oxidării aerobe), care se exprimă în accelerarea descompunerii acizilor grași și a glicerolului. Cum afectează catecolaminele la arderea grăsimilor? În felul următor: suprimarea apetitului; activarea sintezei și secreției de STH lipolitic împiedică eliberarea excesivă de insulină. Pe măsură ce vă antrenați, eliberarea nu este a catecolaminelor în sine, ci a c-AMP („mesager” intracelular pentru unii hormoni), ceea ce crește sensibilitatea celulelor corpului la acestea. În același timp, sensibilitatea celulelor la hormonii tiroidieni, adrenalină și corticosteroizi se îmbunătățește. Printre LTH - hormoni lipotropi - există un astfel de hormon magic precum beta-lipotropina, ale cărui proprietăți biologice includ un efect de mobilizare a grăsimilor, activitate corticotropă și un efect asemănător insulinei, care se reflectă într-o creștere a ratei utilizării glucozei în țesuturi. Efectul lipotrop se realizează și prin sistemul c-AMP, al cărui stadiu final este o enzimă care descompune grăsimile neutre. În plus, endorfina este formată din beta-lipotropină. Alergarea, la rândul său, duce la o sinteză crescută și la intrarea în sânge a endorfinelor care acționează asupra corpului uman ca morfina (fără a încălca adecvarea comportamentului): ameliorează durerea, crește dramatic starea de spirit, provocând euforie și are un efect slab de ardere a grăsimilor.
3. Saună. Orice supraîncălzire în modul cel mai puternic excită sistemul simpatic-suprarenal, determinând pătrunderea în fluxul sanguin a dopaminei, norepinefrinei și adrenalinei. Oamenii instruiți au o eliberare mai mare de norepinefrină decât alți neurotransmițători și, după cum știm, este unul dintre principalii agenți endogeni de ardere a grăsimilor. Răcirea pe termen scurt (puteți sări în piscină după o baie de aburi sau faceți un duș rece) va „stabili căldura” adrenalinei, deoarece se va dovedi cel mai puternic stresor pentru sistemul nervos central. Cu toate acestea, „mușchiul” nu este deloc necesar - răcirea pe termen lung poate bloca lipoliza și îi poate conduce pe cei care sunt transportați în special la sinteza grăsimii subcutanate.
4. Tan. Toată lumea știe că întunecarea pielii cu radiații ultraviolete provoacă melanină - un pigment maro. Este format din aminoacid tirozina, care crește simultan cantitatea de L-DOPA - un precursor al dopaminei, norepinefrinei și adrenalinei din creier și de la periferie. În plus, melanina în sine stimulează sistemul simpatic-suprarenal. Toate acestea fac din bronzare un produs bun pentru arderea grăsimilor. Cu toate acestea, lumina solară naturală îmbunătățește metabolismul principal, ceea ce duce la catabolismul atât al țesutului adipos, cât și al țesutului muscular. Dacă doriți să afectați grăsimea corporală doar prin stimularea sistemului simpatic-suprarenal, fără a crește metabolismul bazal, este necesar să „opriți” razele infraroșii din procesul de iradiere. Acest lucru este ușor de făcut, folosind nu o plajă, ci un solar pentru bronzare, mai ales că într-un climat rusesc, un solar este mult mai accesibil decât soarele „viu”.
5. Nutriție. Un excelent stimulator fiziologic al arderii de grăsimi este tranziția la nutriția proteinelor. Nu vorbim despre o dietă fără carbohidrați. Doar cu mâncare obișnuită, de regulă, oamenii „sortează” cu zahăr și grăsimi. Industria culinară este cel mai probabil de vină pentru acest lucru, prin tehnologia sa de a „îmbunătăți” gustul, termenul de valabilitate și ieftinitatea. Dar acest subiect interesant merită o discuție separată. Trecerea la nutriția proteică în acest caz implică orientarea dietei către alimentele cu conținut redus de grăsimi și fibre (legume, ovăz). Recepția proteinei pure pe stomacul gol (izolatul din zer este mai bun) accelerează ratele schimbului principal cu 15%! Proteinele necesită calorii pentru asimilare, adică în sine arde energie. Proteina previne descompunerea țesutului muscular și stimulează anabolismul său și, după cum știți, mai mult mușchi - mai puține grăsimi. În ceea ce privește modificările hormonale în timpul tranziției la nutriția proteică, aceasta se caracterizează printr-o eliberare mare de hormon de creștere, despre care s-a spus deja efectul de ardere a grăsimilor.
6. Somnul. Da, destul de ciudat, dar un vis poate fi un leac miraculos pentru a scăpa de excesul de grăsime. Cum să organizezi condițiile pentru arderea grăsimilor în timpul somnului? În primul rând, trebuie spus imediat că lipoliza stimulează GH eliberat în primele două ore de somn. Pentru a stimula o astfel de emisie, este de dorit să respectăm următoarele condiții: ultima masă - exclusiv proteină noaptea, este mai bine să bei aminoacizi cristalini cu predominanță de arginină pentru a exclude aportul de seară de alcool, carbohidrați și grăsimi, deoarece toate acestea blochează complet somatotropina. pe calea grasă a nutriției cu ajutorul efectului de mobilizare a grăsimilor din STH. Adică, procesele catabolice în timpul somnului vizează numai țesutul adipos, dacă nutriția este selectată corect. Pentru o acțiune mai lungă a hormonului de creștere în timpul zilei, este indicat să adăugați somn în timpul zilei, cel puțin o oră și jumătate.
Stimulanți farmaceutici pentru arderea grăsimilor
Printre produsele farmaceutice fără prescripție medicală, dintre care unele pot fi găsite în magazinele de nutriție sportivă, există mulți agenți lipolitici. Toată diversitatea lor poate fi împărțită în mai multe grupuri.
1. Adaptogeni. Acest grup de plante (Schisandra chinensis, Radiola rosea, Eleutherococcus, Aralia, Ginseng, Leuzea etc.) crește sensibilitatea celulelor nervoase la adrenalină și predecesorul acesteia. Adaptogeni precum cafeina contribuie la acumularea de c-AMP, care, după cum amintim, îmbunătățește sensibilitatea celulelor la hormonii tiroidieni și adrenalină. Extractele din aceste plante crescând rezistența și stimulând performanța nu provoacă epuizarea c-AMP intracelular, spre deosebire de cofeină, deci pot fi luate în mod continuu. Când se utilizează adaptogeni, sinteza de grăsime este inhibată. Oxidarea acizilor grași în timpul lucrului fizic este îmbunătățită. Sensibilitatea celulelor nervoase se îmbunătățește, iar procesele de excitație din sistemul nervos central cresc. Glicemia este scăzută, ceea ce stimulează eliberarea hormonului de creștere, care îmbunătățește anabolismul proteinelor musculare și accelerează lipoliza.
2. Aminoacizi. Unii aminoacizi liberi contribuie activ la arderea grăsimilor, în principal datorită stimulării eliberării hormonului de creștere. În special, histidina, arginina, ornitina și metionina contribuie la menținerea echilibrului de azot al organismului, sporesc sinteza hormonilor steroizi, protejează împotriva oxidării adrenalinei și neutralizează multe produse toxice. Când metionina este introdusă în organism, cantitatea de grăsime neutră din ficat scade și nivelul colesterolului din sânge scade.
3. Vitamine. Vitaminele precum pantotenatul de calciu, vitamina U și clorura de carnitină afectează în mod direct procesul de ardere a grăsimilor. Prin scăderea glicemiei, acestea contribuie la eliberarea hormonului de creștere. În același timp, sinteza acetilcolinei crește, sporind tonul sistemului nervos parasimpatic, ceea ce contribuie la creșterea forței sistemului neuromuscular. Sinteza hormonilor steroizi și a hemoglobinei este, de asemenea, îmbunătățită. Rezistența și toleranța generală a încărcărilor cresc semnificativ (puteți alerga și sari mai mult - arsurile de grăsime mai rapid). În plus, clorura de carnitină promovează descompunerea acizilor grași și pătrunderea acestora prin membranele mitocondriilor, motiv pentru care este adesea folosit pentru „uscarea” mușchilor. O proprietate valoroasă a vitaminei U este prezența grupărilor metilice labile care pot fi ușor incluse în metabolism, datorită cărora se obțin efecte de mobilizare a grăsimilor și lipolitice.
4. Terapia cu hormoni. În practica sportivă, hormonii înșiși sunt adesea folosiți pentru a maximiza efectul de ardere a grăsimilor. Cele mai populare în acest caz sunt hormonii tiroidieni și hormonul de creștere. Glanda tiroidă este cea mai mare dintre glandele endocrine (până la 20 g). Hormonii săi sunt tiroxina (T4), triiodotironina (TK) și calcitonina, care reglează metabolismul calciului și stimulează depunerea acesteia în țesutul osos. T4 și TK au aceleași proprietăți: cresc rata metabolică a aproape toate țesuturile și pot crește intensitatea metabolismului principal cu 60-100%! De asemenea, - îmbunătățesc sinteza proteinelor - cresc dimensiunea și numărul de mitocondrii în majoritatea celulelor - promovează procesele de glicoliză și gluconeogeneză - cresc mobilizarea lipidelor, crescând cantitatea de acizi grași liberi pentru oxidare.
5. Agenți de ardere a grăsimilor. Cum pot fi „întoarse” hormonii în direcția arderii grăsimilor? Este necesar să afectăm sensibilitatea celulelor la acești aceeași hormoni. Cel mai realist mod de a arde grăsime este de a folosi acțiunea adrenalinei. Unii agenți sunt capabili să interacționeze cu receptorii beta-adrenergici localizați în țesutul adipos. Cu ajutorul unor arzătoare de grăsimi, corpul trece la combustibilul „gras”, lăsând țesutul muscular intact.
Rolul lipidelor în nutriție
Lipidele sunt o componentă esențială a unei diete umane echilibrate. Se crede că, cu o dietă echilibrată, raportul dintre proteine, lipide și carbohidrați din dietă este de aproximativ 1: 1: 4. În medie, aproximativ 80 g de grăsimi animale și vegetale sunt ingerate zilnic de către un adult. La bătrânețe, precum și cu activitate fizică scăzută, nevoia de grăsimi scade, în condiții de climă rece și cu muncă fizică grea - crește.
Importanța grăsimilor ca produs alimentar este foarte diversă. În primul rând, grăsimile din alimentația umană au o valoare energetică importantă. Conținutul ridicat de calorii în grăsimi în comparație cu proteinele și carbohidrații le conferă o valoare nutritivă specială atunci când organismul cheltuiește cantități mari de energie. Se știe că 1 g de grăsime în timpul oxidării în organism dă 38,9 kJ (9,3 kcal), în timp ce 1 g de proteine \u200b\u200bsau carbohidrați dă 17,2 kJ (4,1 kcal). De asemenea, trebuie reținut faptul că grăsimile sunt solvenți ai vitaminelor A, D, E etc., și, prin urmare, disponibilitatea acestor vitamine în organism depinde în mare măsură de aportul de grăsimi din alimente. În plus, unii acizi polinesaturați (linoleic, linolenic, arahidonic) sunt introduși în organism cu grăsimi, care sunt clasificați ca acizi grași esențiali, deoarece țesuturile umane și mai multe animale au pierdut capacitatea de a le sintetiza. Acești acizi sunt combinați în mod convențional într-un grup numit „vitamina F”.
În cele din urmă, cu grăsimile, organismul primește un complex de substanțe biologic active, cum ar fi fosfolipidele, sterolii etc., care joacă un rol important în metabolism.
Digestia și absorbția lipidelor
Defalcarea grăsimilor în tractul gastro-intestinal. Saliva nu conține enzime care se rup. Prin urmare, în cavitatea bucală, grăsimile nu suferă nicio modificare. La adulți, grăsimile trec prin stomac și fără modificări semnificative, deoarece lipasa, care este conținută într-o cantitate mică în sucul gastric al unui adult și mamifere, este inactivă. PH-ul sucului gastric este de aproximativ 1,5, iar pH-ul optim pentru lipaza gastrică se situează în intervalul 5,5-7,5. În plus, lipaza poate hidroliza activ doar grăsimile preemulsionate, în timp ce în stomac nu există condiții pentru emulsionarea grăsimilor.
Digestia grăsimilor din cavitatea stomacului joacă un rol important în procesul de digestie la copii, în special la sugari. Se știe că pH-ul sucului gastric la sugari este de aproximativ 5,0, ceea ce contribuie la digestia grăsimii emulsificate din lapte de către lipaza gastrică. În plus, există motive de a crede că, cu utilizarea prelungită a laptelui ca principal produs alimentar la sugari, se observă o creștere adaptativă a sintezei lipazei gastrice.
Deși nu există o digestie vizibilă a grăsimilor alimentare în stomacul unui adult, distrugerea parțială a complexelor de lipoproteine \u200b\u200bale membranelor celulelor alimentare este observată în stomac, ceea ce face ca grăsimile să fie mai accesibile pentru expunerea ulterioară la lipazele de suc pancreatic. În plus, o ușoară descompunere a grăsimilor în stomac duce la apariția acizilor grași liberi care, care intră în intestine, contribuie la emulsificarea grăsimilor acolo.
Defalcarea grăsimilor care alcătuiesc alimente are loc la om și la mamifere în principal în părțile superioare ale intestinului subțire, unde există condiții foarte favorabile pentru emulsificarea grăsimilor.
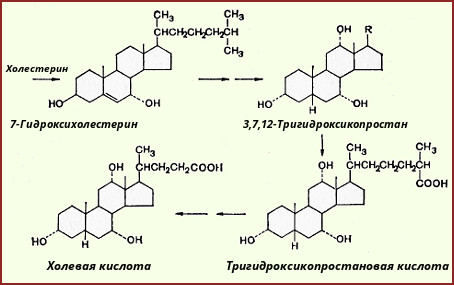
După ce chimia intră în duoden, aici, în primul rând, are loc neutralizarea acidului clorhidric al sucului gastric care intră în intestin cu alimente, bicarbonatele conținute în sucurile pancreatice și intestinale. Bulele de dioxid de carbon eliberate în timpul descompunerii bicarbonatelor contribuie la o bună amestecare a pulpei comestibile cu sucuri digestive. În același timp, începe emulsificarea grăsimilor. Cel mai puternic efect emulsionant asupra grăsimilor este, fără îndoială, exercitat de sărurile acizilor biliari care intră în duoden cu bilă sub formă de săruri de sodiu, majoritatea fiind conjugate cu glicină sau taurină. Acizii biliari sunt principalul produs final al metabolismului colesterolului.
Principalele etape ale formării acizilor biliari din colesterol, în special acidul colic, pot fi reprezentate după cum urmează. Procesul începe cu hidroxilarea colesterolului în a șasea poziție a, adică cu includerea unei grupe hidroxil la poziția 7 și formarea 7-hidroxicolesterolului. Apoi, printr-o serie de etape, se formează acid 3,7,12-trihidroxicoprostanoic, al cărui lanț lateral este supus oxidării β. În stadiul final, acidul propionic este separat (sub formă de propionil CoA) și lanțul lateral este scurtat. Un număr mare de enzime hepatice și coenzime sunt implicate în toate aceste reacții.
Prin natura lor chimică, acizii biliari sunt derivați ai acidului colanic. Bilă umană conține în principal acizi colici (3,7,12-trioxicolanici), deoxihici (3,12-dihidroxicolano- și chenodeeoxicolici (3,7-dihidroxicolanici)).
În plus, acidul litiu (3-hidroxicolanic), precum și acizii alocolici și ureodeoxicolici - stereoizomerii acizilor cholici și chenodeoxicolici - se găsesc în cantități mici (urme) în bila biliară umană.
După cum s-a menționat deja, acizii biliari sunt prezenți în bilă sub formă conjugată, adică sub formă de glicocolici, glicodoxicoli, glicenohenoxicolici (aproximativ 2 / 3-4 / 3 din toți acizii biliari) sau taurocholici, taurodeoxihici și taurohenodeoxihici (aproximativ 1 / 5-1 / 3 din acizii biliari). Acești compuși sunt uneori numiți în pereche, deoarece constau din două componente - din acidul biliar și glicină sau acid biliar și taurină.
Rețineți că raporturile dintre conjugatele acestor două specii pot varia în funcție de natura alimentului: în cazul predominării carbohidraților în el, conținutul relativ de conjugați de glicină crește, iar cu o dietă bogată în proteine, conjugați de taurină. Structura acestor conjugate poate fi reprezentată după cum urmează:
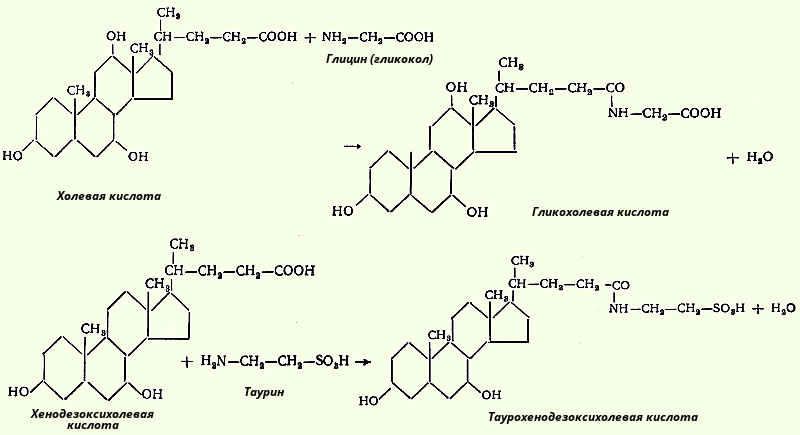
Se crede că doar o combinație: sare de acid biliar + acid gras nesaturat + monogliceridă este capabilă să ofere gradul necesar de emulsificare a grăsimilor. Sărurile biliare reduc brusc tensiunea superficială la interfața grăsime / apă, datorită căreia nu numai că facilitează emulsificarea, dar și stabilizează emulsia deja formată.
Acizii biliari joacă, de asemenea, un rol important ca un fel de activator al lipazei pancreatice 1, sub influența căreia există o descompunere a grăsimii în intestin. Lipasa produsă în pancreas descompune trigliceridele în stare emulsionată. Se crede că efectul activator al acizilor biliari asupra lipazei este exprimat printr-o schimbare în acțiunea optimă a acestei enzime de la pH 8,0 la 6,0, adică la acel pH care este menținut mai constant în duoden în timpul digestiei alimentelor grase. Mecanismul exact de activare a lipazei de către acizii biliari este încă neclar.
1 Cu toate acestea, se crede că activarea lipazei nu are loc sub influența acizilor biliari. Sucul pancreatic conține un precursor al lipazei, care este activat în lumenul intestinal prin complexare cu o colipază (cofactor) într-un raport molar 2: 1. Acest lucru ajută la modificarea optimă a pH-ului de la 9,0 la 6,0 și la prevenirea denaturării enzimei. S-a stabilit, de asemenea, că nici gradul de nesaturare a acizilor grași, nici lungimea lanțului de hidrocarburi (de la C 12 la C 18) nu au un efect semnificativ asupra vitezei de hidroliză catalizată de lipază. Ionii de calciu accelerează hidroliza, în principal, deoarece formează săpunuri insolubile cu acizi grași eliberați, adică practic schimbă reacția în direcția hidrolizei.

Există motive pentru a crede că există două tipuri de lipază pancreatică: una dintre ele este specifică pentru legăturile eterice în pozițiile 1 și 3 ale trigliceridelor, iar cealaltă hidrolizează legăturile în poziția 2. Hidroliza completă a trigliceridelor apare în etape: prima, legăturile 1 și 3 hidrolizează rapid și apoi hidroliza 2-monogliceridei se desfășoară deja lent (schemă).
Trebuie menționat că lipaza intestinală este implicată și în descompunerea grăsimilor, dar activitatea sa este scăzută. Mai mult, această lipază catalizează clivajul hidrolitic al monogliceridelor și nu afectează di- și trigliceridele. Astfel, practic principalele produse formate în intestin în timpul descompunerii grăsimilor alimentare sunt acizii grași, monogliceridele și glicerina.
Absorbția intestinală a grăsimilor. Absorbția are loc în partea proximală a intestinului subțire. Grăsimile subțire emulsionate (dimensiunea picăturilor de grăsime ale emulsiei nu trebuie să depășească 0,5 μm) pot fi parțial absorbite prin peretele intestinal fără hidroliză prealabilă. Cu toate acestea, cea mai mare parte a grăsimii este absorbită numai după descompunerea sa de către lipaza pancreatică în acizi grași, monogliceride și glicerină. Acizii grași cu lanț scurt (mai puțin de 10 atomi de C) și glicerina, fiind bine solubili în apă, sunt absorbiți liber în intestin și intră în sângele venei portale, de acolo în ficat, ocolind orice transformări în peretele intestinal. Mai complicat este cazul acizilor grași cu un lanț lung de carbon și monogliceride. Absorbția acestor compuși are loc cu participarea acizilor biliari și în principal a acizilor biliari care alcătuiesc compoziția sa. În bilă, sărurile biliare, fosfolipidele și colesterolul sunt conținute într-un raport de 12,5: 2,5: 1,0. Acizii grași cu lanț lung și monogliceridele din lumenul intestinal formează micelele (soluție micelară) care sunt stabile în mediul acvatic cu acești compuși. Structura acestor micele este astfel încât nucleul lor hidrofob (acizi grași, gliceride etc.) se dovedește a fi înconjurat la exterior de o coajă hidrofilă a acizilor biliari și fosfolipide. Micelele sunt de aproximativ 100 de ori mai mici decât cele mai mici picături de grăsime emulsionate. În micelele, acizii grași mai mari și monogliceridele sunt transferați de la locul hidrolizei de grăsime pe suprafața de aspirație a epiteliului intestinal. Nu există un consens asupra mecanismului de absorbție a micelelor grase. Unii cercetători consideră că, ca urmare a așa-numitei difuzii micelare și, eventual, a pinocitozei, micelele ca o particulă întreagă pătrund în celulele epiteliale ale vilozelor. Micelele grase se descompun aici; în acest caz, acizii biliari intră imediat în fluxul de sânge și prin sistemul venelor portale intră în ficat, de unde sunt din nou secretați în compoziția bilei. Alți cercetători sugerează că numai componentele lipidice ale micelelor grase pot trece în celulele vililor. Și sărurile biliare, care și-au îndeplinit rolul fiziologic, rămân în lumenul intestinal. Și abia atunci, în marea majoritate, sunt absorbiți în sânge (în ileon), intră în ficat și apoi sunt excretați în bilă. Astfel, ambii cercetători recunosc că există o circulație constantă a acizilor biliari între ficat și intestine. Acest proces se numește circulație hepatic-intestinală (enterohepatică).
Folosind metoda de atomi etichetați, s-a arătat că bila este conținută doar cu o porțiune mică de acizi biliari (10-15% din total), sintetizată recent de ficat, adică majoritatea acizilor biliari ai bilei (85-90%) sunt acizi biliari reabsorbit în intestin și re-secretat în compoziția bilei. S-a stabilit că, la om, acumulatorul total de acizi biliari este de aproximativ 2,8-3,5 g; în timp ce fac 5-6 revoluții pe zi.
Resinteza grăsimilor din peretele intestinal. Grăsimile sunt sintetizate în peretele intestinal, care sunt semnificativ specifice pentru o anumită specie de animal și diferă în natură de grăsimile alimentare. Într-o anumită măsură, acest lucru este asigurat de faptul că, împreună cu acizii grași exogeni și endogeni, participă la sinteza trigliceridelor (precum și a fosfolipidelor) din peretele intestinal. Cu toate acestea, capacitatea de a sintetiza grăsimea specifică pentru o anumită specie de animal în mașina intestinală este încă limitată. A. N. Lebedev a arătat că atunci când hrănește un animal, în special înfometat anterior, cantități mari de grăsimi străine (de exemplu, ulei de in sau grăsime de cămilă), o parte din acesta se găsește în țesutul adipos al animalului neschimbat. Depozitele de grăsime sunt cel mai probabil singurul țesut în care pot fi depuse grăsimi străine. Lipidele care alcătuiesc protoplasma celulelor altor organe și țesuturi sunt foarte specifice, compoziția și proprietățile lor sunt puțin dependente de grăsimea dietetică.
Mecanismul resintezei trigliceridelor în celulele peretelui intestinal, în general, este următorul: inițial, forma lor activă, acil-CoA, este formată din acizi grași, după care monogliceridele sunt acilate cu formarea digliceridelor și apoi trigliceride:
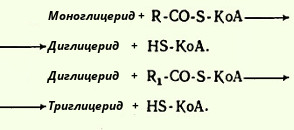
Astfel, în celulele epiteliului intestinal al animalelor superioare, monogliceridele formate în intestin în timpul digestiei alimentare pot fi acilate direct, fără stadii intermediare.
Cu toate acestea, celulele epiteliale ale intestinului subțire conțin enzime - lipaza monogliceridă, care descompune monoglicerida în glicerol și acid gras, și glicerol kinază, care poate converti glicerolul (format din monoglicerid sau absorbit din intestin) în glicerol-3-fosfat. Acesta din urmă, interacționând cu forma activă a acidului gras - acil-CoA, dă acid fosfatidic, care este apoi utilizat pentru resinteza trigliceridelor și în special a glicerofosfolipidelor (vezi mai jos pentru detalii).
Digestia și absorbția glicerofosfolipidelor și a colesterolului. Glicerofosfolipidele introduse împreună cu alimentele sunt expuse în intestin la enzime hidrolitice specifice care rup legăturile eterice dintre componentele care alcătuiesc fosfolipidele. Se crede că în tractul digestiv, descompunerea glicerofosfolipidelor are loc cu participarea fosfolipazelor secretate cu suc pancreatic. Mai jos este o diagramă a clivajului hidrolitic al fosfatidilcolinei:
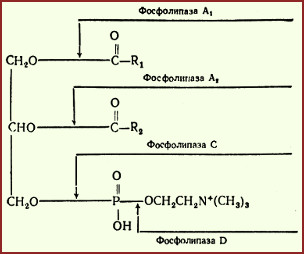
Există mai multe tipuri de fosfolipaze.
- Fosfolipasa A 1 hidrolizează legătura esterică în poziția 1 a glicerofosfolipidului, ca urmare a căreia se scindează o moleculă a acidului gras și, de exemplu, se formează 2-acilglicerilfosforilcolina atunci când se scindează fosfatidilcolina.
- Fosfolipasa A 2, numită anterior fosfolipază A, catalizează clivajul hidrolitic al unui acid gras în poziția 2 a glicerofosfolipidului. Produsele rezultate sunt denumite lisofosfatidilcolină și lisofosfatidiletanolamină. Sunt toxice și provoacă distrugerea membranelor celulare. Activitatea ridicată a fosfolipazei A 2 în veninul șerpilor (cobra etc.) și a scorpionilor duce la faptul că, atunci când mușcă, hemolizele hemolizează.
Fosfolipasa pancreatică A 2 intră în cavitatea intestinului subțire într-o formă inactivă și numai după expunerea la trypsină, ceea ce duce la scindarea heptapeptidei din ea, capătă activitate. Acumularea lizofosfolipidelor în intestin poate fi eliminată dacă ambele fosfolipaze acționează simultan asupra glicerofosfolipidelor: A 1 și A 2. Ca urmare, se formează un produs care nu este toxic pentru organism (de exemplu, în timpul descompunerii fosfotidilcolinei - glicerilfosforilcolină).
- Fosfolipasa C determină hidroliza legăturii dintre acidul fosforic și glicerol, iar fosfolipasa D clivează legătura eterică între baza azotată și acidul fosforic pentru a forma baza liberă și acidul fosfatidic.
Deci, ca urmare a acțiunii fosfolipazelor, glicerofosfolipidele se descompun odată cu formarea de glicerol, acizi grași superiori, o bază azotată și acid fosforic.
Trebuie menționat că în țesuturile corpului există un mecanism similar pentru descompunerea glicerofosfolipidelor; Acest proces este catalizat de fosfolipazele tisulare. Rețineți că secvența reacțiilor pentru clivarea glicerofosfolipidelor în componente individuale este încă necunoscută.
Am avut deja în vedere mecanismul de absorbție a acizilor grași mai mari și a glicerolului. Acidul fosforic este absorbit de peretele intestinal în principal sub formă de săruri de sodiu sau potasiu. Bazele azotate (colină și etanolamină) sunt absorbite sub formele lor active.
După cum sa menționat deja, glicerofosfolipidele sunt sintetizate în peretele intestinal. Componentele necesare sintezei: acizi grași mai mari, glicerină, acid fosforic, baze azotate organice (colină sau etanolamină) intră în celula epitelială atunci când sunt absorbite din cavitatea intestinală, deoarece acestea sunt formate în timpul hidrolizei grăsimilor și lipidelor comestibile; parțial, aceste componente sunt livrate celulelor epiteliale intestinale cu flux de sânge din alte țesuturi. Resintetica glicerofosfolipidă trece prin etapa de formare a acidului fosfatidic.
În ceea ce privește colesterolul, acesta intră în sistemul digestiv uman în principal cu gălbenușul de ou, carnea, ficatul și creierul. Un corp uman adult primește zilnic 0,1-0,3 g de colesterol conținut în produsele alimentare, fie sub formă de colesterol liber, fie sub formă de esteri (colesterizi). Esterii colesterolului se descompun în colesterol și acizi grași, cu participarea unei enzime speciale de sucuri pancreatice și intestinale - colesterolul esterază. Colesterolul insolubil în apă, la fel ca acizii grași, este absorbit în intestin doar în prezența acizilor biliari.
Formarea chilomicronului și transportul lipidelor. Trigliceridele și fosfolipidele, care sunt re-sintetizate în celulele epiteliale intestinale, precum și colesterolul (care îl poate esterifica parțial), primit în aceste celule din cavitatea intestinală, se combină cu o cantitate mică de proteine \u200b\u200bși formează particule complexe relativ stabile - chilomicroni (ChM). Acestea din urmă conțin aproximativ 2% proteine, 7% fosfolipide, 8% colesterol și esterii săi și peste 80% trigliceride. Diametrul XM variază între 100 și 5000 nm. Datorită mărimii mari a particulelor, XM nu poate pătrunde din celulele endoteliale intestinale în capilarele sanguine și difuză în sistemul limfatic intestinal, iar din ea în canalul limfatic toracic. Apoi, din canalul limfatic toracic, XM intră în fluxul sanguin, adică sunt utilizate pentru a transporta trigliceridele exogene, colesterolul și parțial fosfolipidele din intestin prin sistemul limfatic în sânge. Deja la 1-2 ore după o masă care conține lipide, se observă hiperlipemia alimentară. Acesta este un fenomen fiziologic, caracterizat în principal printr-o creștere a concentrației de trigliceride în sânge și apariția ChM în acesta. Vârful hiperlipemiei alimentare apare la 4-6 ore după ingestia alimentelor grase. De obicei, după 10-12 ore după mâncare, conținutul de trigliceride revine la valorile normale, iar ChM dispare complet din fluxul sanguin.
Se știe că ficatul și țesutul adipos joacă cel mai important rol în soarta viitoare a XM. Acestea din urmă se difuzează liber de plasma sanguină în spațiile intercelulare ale ficatului (sinusoide). Se presupune că hidroliza trigliceridelor XM apare atât în \u200b\u200binteriorul celulelor hepatice, cât și pe suprafața lor. În ceea ce privește țesutul adipos, chilomicronii nu sunt capabili (datorită mărimii lor) să pătrundă în celulele sale. În acest sens, trigliceridele XM sunt supuse hidrolizei la suprafața endoteliului capilarelor țesutului adipos cu participarea enzimei lipoproteidlipază, care este strâns legată de suprafața endoteliului capilar. Ca urmare, se formează acizi grași și glicerină. O parte din acizii grași trece în celulele grase, iar o parte este legată de albumina serică și transportată cu curentul său. Odată cu fluxul de sânge, țesutul gras și glicerina pot pleca.
Clivarea trigliceridelor XM în ficat și în capilarele de sânge ale țesutului adipos duce de fapt la încetarea XM.
Metabolizarea lipidelor intermediare. Cuprinde următoarele procese principale: defalcarea trigliceridelor în țesuturi cu formarea de acizi grași mai mari și glicerol, mobilizarea acizilor grași din depozitele de grăsimi și oxidarea acestora, formarea de corpuri de acetonă (corpuri cetonice), biosinteza acizilor grași mai mari, trigliceride, glicerofosfolipide, sfingolipide, colesterol etc. d.
Lipoliza intracelulară
Principala sursă endogenă de acizi grași utilizată ca „combustibil” este grăsimea de rezervă conținută în țesutul adipos. Se crede că trigliceridele depozitelor de grăsimi joacă același rol în metabolismul lipidelor ca glicogenul hepatic în metabolismul carbohidraților, iar acizii grași superiori se aseamănă cu glucoza în rolul său, care se formează în timpul fosforolizei glicogenului. În timpul muncii fizice și în alte condiții ale organismului care necesită cheltuieli energetice sporite, consumul de trigliceride de țesut adipos crește o rezervă de energie.
Deoarece numai acizii grași liberi, adică liberi, non-esterificați, pot fi folosiți ca surse de energie, trigliceridele sunt mai întâi hidrolizate folosind enzime tisulare specifice - lipaze - la glicerol și acizi grași liberi. Ultimul depozit de grăsimi poate trece în plasma sanguină (mobilizarea acizilor grași superiori), după care sunt utilizate de țesuturile și organele corpului ca material energetic.
Țesutul adipos conține mai multe lipaze, dintre care lipaza trigliceridă (așa-numita lipază sensibilă la hormoni), lipaza digliceridă și lipaza monogliceridă sunt de cea mai mare importanță. Activitatea ultimelor două enzime este de 10-100 de ori mai mare decât activitatea primei. Trigliceridlipasa este activată de o serie de hormoni (de exemplu, adrenalină, norepinefrină, glucagon etc.), în timp ce digliceridlipază și monogliceridlipază sunt insensibile la acțiunea lor. Triglicerida lipază este o enzimă regulatoare.
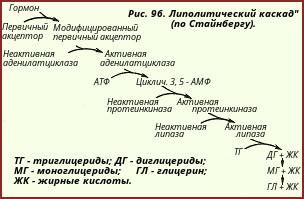
S-a stabilit că lipaza sensibilă la hormoni (triglicerida lipază) se află în țesutul adipos într-o formă inactivă și este activată de cAMP. Ca urmare a acțiunii hormonilor, receptorul primar al celulelor își modifică structura și în această formă este capabil să activeze enzima adenilat ciclază, care la rândul său stimulează formarea de cAMP din ATP. CAMP-ul rezultat activează enzima proteinei kinazei, care prin fosforilarea lipazei trigliceridelor inactive o transformă într-o formă activă (Fig. 96). Lipaza trigliceridă activă descompune triglicerida (TG) în digliceridă (DG) și acid gras (FA). Apoi, sub acțiunea lipazei di- și monogliceride, se formează produsele finale ale lipolizei - glicerol (GL) și acizi grași liberi, care intră în fluxul sanguin.
Asociat cu albumina plasmatică sub formă de complexe, acizi grași liberi cu flux de sânge intră în organele și țesuturile unde se descompun complexul, iar acizii grași suferă fie β-oxidare, sau unii dintre ei sunt folosiți pentru sintetizarea trigliceridelor (care apoi continuă să formeze lipoproteine), glicerofosfolipide, sfingolipide și alți compuși, precum și esterificarea colesterolului.
O altă sursă de acizi grași sunt fosfolipidele membranare. Reînnoirea metabolică a fosfolipidelor are loc continuu în celulele animalelor superioare, timp în care se formează acizi grași liberi (produsul acțiunii fosfolipazelor tisulare).