Ievads
Atomi, kas sākotnēji tika uzskatīti par nedalāmiem, ir sarežģītas sistēmas. Viņiem ir masīvs protonu un neitronu kodols, ap kuru elektroni pārvietojas tukšā telpā. Atomi ir ļoti mazi – to izmēri ir aptuveni 10 –10 –10 –9 m, un kodola izmēri joprojām ir aptuveni 100 000 reižu mazāki (10 –15 –10 –14 m). Tāpēc atomus var “redzēt” tikai netieši, attēlā ar ļoti lielu palielinājumu (piemēram, izmantojot lauka emisijas projektoru). Bet pat šajā gadījumā atomus nevar redzēt sīkāk. Mūsu zināšanas par to iekšējo struktūru balstās uz milzīgu eksperimentālu datu apjomu, kas netieši, bet pārliecinoši apstiprina iepriekš minēto. Priekšstati par atoma uzbūvi radikāli mainījās 20. gadsimtā. ko ietekmē jaunas teorētiskas idejas un eksperimentālie dati. Atoma kodola iekšējās struktūras aprakstā joprojām ir neatrisināti jautājumi, kas ir intensīvas izpētes priekšmets. Nākamajās sadaļās ir izklāstīta ideju attīstības vēsture par atoma uzbūvi kopumā; Atsevišķs raksts ir veltīts kodola uzbūvei (ATOMIC NUCLEUS STUCTURE), jo šīs idejas attīstījās lielā mērā neatkarīgi. Enerģija, kas nepieciešama, lai izpētītu atoma ārējos apvalkus, ir salīdzinoši maza, siltumenerģijas vai ķīmiskās enerģijas ziņā. Šī iemesla dēļ elektroni tika eksperimentāli atklāti ilgi pirms kodola atklāšanas. Kodols, neskatoties uz nelielo izmēru, ir ļoti stipri saistīts, tāpēc to var iznīcināt un pētīt tikai ar spēku palīdzību, kas miljoniem reižu intensīvāki par spēkiem, kas darbojas starp atomiem. Straujais progress kodola iekšējās struktūras izpratnē sākās tikai līdz ar daļiņu paātrinātāju parādīšanos. Tieši šī milzīgā izmēra un saistīšanas enerģijas atšķirība ļauj mums aplūkot atoma struktūru kopumā atsevišķi no kodola struktūras. Lai iegūtu priekšstatu par atoma izmēru un tukšo vietu, ko tas aizņem, apsveriet atomus, kas veido ūdens pilienu ar diametru 1 mm. Ja jūs garīgi palielināsiet šo pilienu līdz Zemes izmēram, tad ūdens molekulā iekļauto ūdeņraža un skābekļa atomu diametrs būs 1–2 m. Katra atoma masas lielākā daļa ir koncentrēta tā kodolā, diametrs no kuriem bija tikai 0,01 mm .
Galvenā daļa
es Ideju evolūcija par atomu uzbūvi
Atoma sarežģītās struktūras atklāšana ir vissvarīgākais posms mūsdienu fizikas attīstībā. Kvantitatīvās atomu uzbūves teorijas veidošanas procesā, kas ļāva izskaidrot atomu sistēmas, veidojās jauni priekšstati par mikrodaļiņu īpašībām, kuras apraksta kvantu mehānika.
Ideja par atomiem kā nedalāmām mazākajām vielu daļiņām, kā minēts iepriekš, radās senatnē (Demokrits, Epikūrs, Lukrēcijs). Viduslaikos doktrīna par atomiem, būdama materiālistiska, netika atzīta. Līdz 18. gadsimta sākumam. atomu teorija iegūst arvien lielāku popularitāti. Līdz tam laikam franču ķīmiķa A. Lavuazjē (1743–1794), izcilā krievu zinātnieka M.V. Lomonosovs un angļu ķīmiķis un fiziķis D. Daltons (1766–1844) pierādīja atomu esamības realitāti. Tomēr šajā laikā jautājums par atomu iekšējo struktūru pat neradās, jo atomi tika uzskatīti par nedalāmiem.
Lielu lomu atomu teorijas attīstībā spēlēja izcilais krievu ķīmiķis D.I. Mendeļejevs, kurš 1869. gadā izstrādāja periodisko elementu sistēmu, kurā pirmo reizi uz zinātniska pamata tika izvirzīts jautājums par atomu vienoto dabu. 19. gadsimta otrajā pusē. Eksperimentāli ir pierādīts, ka elektrons ir viena no jebkuras vielas galvenajām daļām. Šie secinājumi, kā arī daudzie eksperimentālie dati noveda pie tā, ka 20. gs. Nopietni radās jautājums par atoma uzbūvi.
Dabiskā saikne starp visiem ķīmiskajiem elementiem, kas skaidri izteikta Mendeļejeva periodiskajā sistēmā, liecina, ka visu atomu struktūra balstās uz kopīgu īpašību: tie visi ir cieši saistīti viens ar otru.
Tomēr līdz 19. gadsimta beigām. Ķīmijā dominēja metafiziskā pārliecība, ka atoms ir vienkāršās matērijas mazākā daļiņa, matērijas dalāmības galīgā robeža. Visu ķīmisko pārvērtību laikā tiek iznīcinātas un atkal radītas tikai molekulas, savukārt atomi paliek nemainīgi un nav sadalāmi mazākās daļās.
Ilgu laiku dažādus pieņēmumus par atoma uzbūvi neapstiprināja nekādi eksperimentālie dati. Tikai 19. gadsimta beigās. tika veikti atklājumi, kas parādīja atoma uzbūves sarežģītību un iespēju noteiktos apstākļos dažus atomus pārveidot citos. Pamatojoties uz šiem atklājumiem, sāka strauji attīstīties doktrīna par atoma uzbūvi.
Pirmie netiešie pierādījumi par atomu sarežģīto struktūru tika iegūti, pētot katoda starus, kas rodas elektriskās izlādes laikā ļoti retinātās gāzēs. Šo staru īpašību izpēte ļāva secināt, ka tie ir sīku daļiņu plūsma, kas nes negatīvu elektrisko lādiņu un lido ar ātrumu, kas ir tuvu gaismas ātrumam. Izmantojot īpašus paņēmienus, bija iespējams noteikt katoda daļiņu masu un to lādiņa lielumu, kā arī noskaidrot, ka tie nav atkarīgi ne no mēģenē palikušās gāzes veida, ne no vielas, no kuras elektrodi. ir izgatavoti vai citos eksperimentālos apstākļos. Turklāt katoda daļiņas ir zināmas tikai uzlādētā stāvoklī, un tās nevar noņemt no lādiņiem un pārvērst elektriski neitrālās daļiņās: elektriskais lādiņš ir to būtība. Šīs daļiņas, ko sauc par elektroniem, 1897. gadā atklāja angļu fiziķis J. Tomsons.
Atoma uzbūves izpēte praktiski sākās 1897.–1898.gadā, kad beidzot tika noskaidrots katodstaru kā elektronu plūsmas raksturs un noteikts elektrona lādiņš un masa. Tomsons ierosināja pirmo atoma modeli, parādot atomu kā matērijas kopu ar pozitīvu elektrisko lādiņu, kurā ir mijas tik daudz elektronu, ka tas pārvērš to elektriski neitrālā veidojumā. Šajā modelī tika pieņemts, ka ārējās ietekmes ietekmē elektroni var svārstīties, t.i., pārvietoties ar paātrinātu ātrumu. Šķiet, ka tas ļāva atbildēt uz jautājumiem par gaismas emisiju no vielas atomiem un gamma stariem ar radioaktīvo vielu atomiem.
Tomsona atoma modelis nepieņēma pozitīvi lādētas daļiņas atoma iekšpusē. Bet kā tad mēs varam izskaidrot radioaktīvo vielu radīto pozitīvi lādētu alfa daļiņu emisiju? Tomsona atomu modelis neatbildēja uz dažiem citiem jautājumiem.
1911. gadā angļu fiziķis E. Rezerfords, pētot alfa daļiņu kustību gāzēs un citās vielās, atklāja pozitīvi lādētu atoma daļu. Turpmākie rūpīgāki pētījumi parādīja, ka, paralēlu staru kūlim izejot cauri gāzes slāņiem vai plānai metāla plāksnei, izceļas vairs nevis paralēli stari, bet gan nedaudz atšķirīgi: alfa daļiņas ir izkliedētas, t.i., tās novirzās no sākotnējā ceļa. Izlieces leņķi ir mazi, taču vienmēr ir neliels skaits daļiņu (apmēram viena no vairākiem tūkstošiem), kas tiek novirzītas ļoti spēcīgi. Dažas daļiņas tiek izmestas atpakaļ tā, it kā tās būtu saskārušās ar necaurredzamu barjeru. Tie nav elektroni – to masa ir daudz mazāka par alfa daļiņu masu. Izliece var rasties, saduroties ar pozitīvām daļiņām, kuru masa ir tādā pašā kārtībā kā alfa daļiņu masa. Pamatojoties uz šiem apsvērumiem, Rezerfords ierosināja šādu atoma struktūras diagrammu.
Atoma centrā atrodas pozitīvi lādēts kodols, ap kuru dažādās orbītās rotē elektroni. Centrbēdzes spēks, kas rodas to rotācijas laikā, tiek līdzsvarots ar piesaisti starp kodolu un elektroniem, kā rezultātā tie paliek noteiktos attālumos no kodola. Tā kā elektrona masa ir niecīga, gandrīz visa atoma masa ir koncentrēta tā kodolā. Kodola un elektronu daļa, kuru skaits ir salīdzinoši neliels, veido tikai nenozīmīgu daļu no kopējās atomu sistēmas aizņemtās telpas.
Rezerforda piedāvātā atoma struktūras diagramma vai, kā parasti saka, atoma planētu modelis, viegli izskaidro alfa daļiņu novirzes parādības. Patiešām, kodola un elektronu izmērs ir ārkārtīgi mazs, salīdzinot ar visa atoma izmēru, ko nosaka elektronu orbītas, kas atrodas vistālāk no kodola, tāpēc lielākā daļa alfa daļiņu lido cauri atomiem bez manāmas novirzes. Tikai tajos gadījumos, kad alfa daļiņa nonāk ļoti tuvu kodolam, elektriskā atgrūšanās izraisa tās krasu novirzīšanos no sākotnējā ceļa. Tādējādi alfa daļiņu izkliedes izpēte lika pamatu atoma kodolteorijai.
II. Bora postulāti
Atoma planetārais modelis ļāva izskaidrot matērijas alfa daļiņu izkliedes eksperimentu rezultātus, taču radās fundamentālas grūtības attaisnot atomu stabilitāti. Pirmo mēģinājumu izveidot kvalitatīvi jaunu – kvantu – atoma teoriju 1913. gadā veica Nīls Bors. Viņš izvirzīja mērķi saistīt vienā veselumā līniju spektru empīriskos likumus, atoma Raterforda kodolmodeli un gaismas emisijas un absorbcijas kvantu raksturu. Bors savu teoriju balstīja uz Rezerforda kodolmodeli. Viņš ierosināja, ka elektroni ap kodolu pārvietojas apļveida orbītā. Apļveida kustībai pat nemainīgā ātrumā ir paātrinājums. Šī paātrinātā lādiņa kustība ir līdzvērtīga maiņstrāvai, kas rada mainīgu elektromagnētisko lauku telpā. Šī lauka izveidošanai tiek patērēta enerģija. Lauka enerģiju var radīt elektrona un kodola Kulona mijiedarbības enerģija. Rezultātā elektronam jāpārvietojas pa spirāli un jānokrīt uz kodolu. Tomēr pieredze rāda, ka atomi ir ļoti stabili veidojumi. No tā izriet, ka klasiskās elektrodinamikas rezultāti, kas balstīti uz Maksvela vienādojumiem, nav piemērojami intraatomiskajiem procesiem. Ir jāatrod jauni modeļi. Savu atoma teoriju Bors pamatoja ar šādiem postulātiem.
Bora pirmais postulāts(stacionāro stāvokļu postulāts): atomā ir stacionāri (laikā nemainās) stāvokļi, kuros tas neizstaro enerģiju. Stacionārie atoma stāvokļi atbilst stacionārām orbītām, pa kurām pārvietojas elektroni. Elektronu kustību stacionārās orbītās nepavada elektromagnētisko viļņu emisija.Šis postulāts ir pretrunā ar klasisko teoriju. Stacionārā atoma stāvoklī elektronam, kas pārvietojas pa apļveida orbītu, ir jābūt diskrētām leņķiskā impulsa kvantu vērtībām.
Bora otrais postulāts(frekvences noteikums): kad elektrons pārvietojas no vienas stacionāras orbītas uz otru, viens fotons ar enerģiju tiek emitēts (absorbēts)
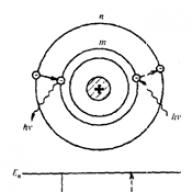
vienāda ar starpību starp atbilstošo stacionāro stāvokļu enerģijām (En un Em ir attiecīgi atoma stacionāro stāvokļu enerģijas pirms un pēc starojuma/absorbcijas). Elektrona pāreja no stacionāra orbītas numura m uz stacionāru orbītas numuru n atbilst atoma pārejai no stāvokļa ar enerģiju Em stāvoklī ar enerģiju En (1. att.). 
1. att. Uz Bora postulātu skaidrojumu
рEn>Em notiek fotonu emisija (atoma pāreja no stāvokļa ar augstāku enerģiju stāvoklī ar zemāku enerģiju, t.i., elektrona pāreja no orbītas, kas atrodas tālāk no kodola, uz tuvāku), pie En.<Еm – его поглощение (переход атома в состояние с большей энергией, т. е, переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот ![]() kvantu pārejas un nosaka atoma līniju spektru. Bora teorija lieliski izskaidroja eksperimentāli novēroto ūdeņraža līniju spektru. Ūdeņraža atoma teorijas panākumi tika sasniegti uz atteikšanās no klasiskās mehānikas pamatprincipiem, kas ir palikuši bez nosacījumiem spēkā vairāk nekā 200 gadus. Tāpēc liela nozīme bija tiešiem eksperimentāliem Bora postulātu, īpaši pirmā – par stacionāro stāvokļu pastāvēšanas – pamatotības pierādījumiem. Otro postulātu var uzskatīt par enerģijas nezūdamības likuma un hipotēzes par fotonu esamību sekām. Vācu fiziķi D. Franks un G. Hercs, pētot elektronu sadursmi ar gāzes atomiem, izmantojot aizkavējošā potenciāla metodi (1913), eksperimentāli apstiprināja stacionāro stāvokļu esamību un atomu enerģijas vērtību diskrētumu. Neskatoties uz neapšaubāmiem Bora koncepcijas panākumiem attiecībā uz ūdeņraža atomu, kuram izrādījās iespējams izveidot kvantitatīvu spektra teoriju, nebija iespējams izveidot līdzīgu teoriju hēlija atomam blakus ūdeņradim, pamatojoties uz Bora atomu. idejas. Attiecībā uz hēlija atomu un sarežģītākiem atomiem Bora teorija ļāva izdarīt tikai kvalitatīvus (kaut arī ļoti svarīgus) secinājumus. Ideja par noteiktām orbītām, pa kurām elektrons pārvietojas Bora atomā, izrādījās ļoti nosacīta. Patiesībā elektronu kustībai atomā ir maz kopīga ar planētu kustību orbītā. Šobrīd ar kvantu mehānikas palīdzību ir iespējams atbildēt uz daudziem jautājumiem par jebkuru elementu atomu uzbūvi un īpašībām.
kvantu pārejas un nosaka atoma līniju spektru. Bora teorija lieliski izskaidroja eksperimentāli novēroto ūdeņraža līniju spektru. Ūdeņraža atoma teorijas panākumi tika sasniegti uz atteikšanās no klasiskās mehānikas pamatprincipiem, kas ir palikuši bez nosacījumiem spēkā vairāk nekā 200 gadus. Tāpēc liela nozīme bija tiešiem eksperimentāliem Bora postulātu, īpaši pirmā – par stacionāro stāvokļu pastāvēšanas – pamatotības pierādījumiem. Otro postulātu var uzskatīt par enerģijas nezūdamības likuma un hipotēzes par fotonu esamību sekām. Vācu fiziķi D. Franks un G. Hercs, pētot elektronu sadursmi ar gāzes atomiem, izmantojot aizkavējošā potenciāla metodi (1913), eksperimentāli apstiprināja stacionāro stāvokļu esamību un atomu enerģijas vērtību diskrētumu. Neskatoties uz neapšaubāmiem Bora koncepcijas panākumiem attiecībā uz ūdeņraža atomu, kuram izrādījās iespējams izveidot kvantitatīvu spektra teoriju, nebija iespējams izveidot līdzīgu teoriju hēlija atomam blakus ūdeņradim, pamatojoties uz Bora atomu. idejas. Attiecībā uz hēlija atomu un sarežģītākiem atomiem Bora teorija ļāva izdarīt tikai kvalitatīvus (kaut arī ļoti svarīgus) secinājumus. Ideja par noteiktām orbītām, pa kurām elektrons pārvietojas Bora atomā, izrādījās ļoti nosacīta. Patiesībā elektronu kustībai atomā ir maz kopīga ar planētu kustību orbītā. Šobrīd ar kvantu mehānikas palīdzību ir iespējams atbildēt uz daudziem jautājumiem par jebkuru elementu atomu uzbūvi un īpašībām.
III. Atomu kodola uzbūve
Atomu kodola uzbūve
Nukleona līmenis
Apmēram 20 gadus pēc tam, kad Rezerfords “atklāja” savu kodolu atoma dziļumos, tika atklāts neitrons - daļiņa visās tā īpašībās tāda pati kā ūdeņraža atoma kodols - protons, bet tikai bez elektriskā lādiņa. Neitrons izrādījās ārkārtīgi ērts kodolu iekšpuses zondēšanai. Tā kā tas ir elektriski neitrāls, kodola elektriskais lauks to neatgrūž - attiecīgi arī lēni neitroni var viegli pietuvoties kodolam attālumos, kuros sāk izpausties kodolspēki. Pēc neitrona atklāšanas mikropasaules fizika virzījās uz priekšu ar lēcieniem un robežām.
Drīz pēc neitrona atklāšanas divi teorētiskie fiziķi - vācietis Verners Heizenbergs un padomju laikos Dmitrijs Ivanenko - izvirzīja hipotēzi, ka atoma kodols sastāv no neitroniem un protoniem. Uz to balstās mūsdienu izpratne par kodola uzbūvi.
Protoni un neitroni tiek apvienoti ar vārdu nukleons. Protoni ir elementārdaļiņas, kas ir vieglākā ķīmiskā elementa - ūdeņraža - atomu kodoli. Protonu skaits kodolā ir vienāds ar elementa atomu skaitu periodiskajā tabulā un tiek apzīmēts ar Z (neitronu skaits - N). Protonam ir pozitīvs elektriskais lādiņš, kas pēc absolūtās vērtības ir vienāds ar elementāro elektrisko lādiņu. Tas ir aptuveni 1836 reizes smagāks par elektronu. Protons sastāv no diviem augšupvērstiem kvarkiem ar lādiņu Q = + 2/3 un viena d-kvarka ar Q = – 1/3, kas savienoti ar gluona lauku. Tā galīgie izmēri ir 10-15 m, lai gan to nevar iedomāties kā cietu bumbiņu, tas drīzāk atgādina mākoni ar neskaidru robežu, kas sastāv no izveidotām un iznīcinātām virtuālajām daļiņām.
Neitrona elektriskais lādiņš ir 0, tā masa ir aptuveni 940 MeV. Neitrons sastāv no viena U-kvarka un diviem d-kvarkiem. Šī daļiņa ir stabila tikai stabilu atomu kodolu sastāvā, brīvais neitrons sadalās elektronā, protonā un elektronu antineitrīnā. Neitrona pussabrukšanas periods (laiks, kas nepieciešams, lai puse no sākotnējā neitronu skaita sabrūk) ir aptuveni 12 minūtes. Vielā neitroni brīvā formā pastāv vēl mazāk laika, jo kodoli tos spēcīgi absorbē. Tāpat kā protons, neitrons piedalās visa veida mijiedarbībās, ieskaitot elektromagnētiskos: ar vispārēju neitralitāti, pateicoties tā sarežģītajai iekšējai struktūrai, tajā pastāv elektriskās strāvas.
Kodolā nukleonus saista īpaša veida spēks - kodols. Viena no to raksturīgajām iezīmēm ir īslaicīga darbība: 10-15 m vai mazākos attālumos tie pārsniedz jebkurus citus spēkus, kā rezultātā nukleoni neizlido līdzīgi lādētu protonu elektrostatiskās atgrūšanas ietekmē. . Lielos attālumos kodolspēki ļoti ātri samazinās līdz nullei.
Kodolspēku darbības mehānisms ir balstīts uz to pašu principu kā elektromagnētiskie spēki – uz mijiedarbojošo objektu apmaiņu ar virtuālajām daļiņām.
Virtuālās daļiņas kvantu teorijā ir daļiņas, kurām ir tādi paši kvantu skaitļi (griešanās, elektriskie un barionu lādiņi u.c.) kā attiecīgajām reālajām daļiņām, bet kurām parastā attiecība starp enerģiju, impulsu un masu nepastāv.
IV. Rezerforda eksperimenti

Magnētiskā laukā radioaktīvā starojuma plūsma sadalās 3 komponentos: alfa staros, beta staros un gamma staros.

Radioaktivitātes parādība norādīja uz atoma sarežģīto struktūru
Secinājums
Noslēgumā mēs nonākam pie secinājuma, ka Rezerforda-Bora koncepcija jau ir vairāk nekā absolūtas patiesības daļiņas, lai gan fizikas tālākā attīstība šajā koncepcijā ir atklājusi daudzas kļūdas. Vēl lielāka daļa absolūti pareizu zināšanu ir ietverta atoma kvantu mehāniskajā teorijā.
Atomu sarežģītās struktūras atklāšana bija nozīmīgs notikums fizikā, jo tika atspēkotas klasiskās fizikas idejas par atomiem kā cietām un nedalāmām matērijas struktūrvienībām.
Lāzeri
Pamatojoties uz starojuma kvantu teoriju, tika uzbūvēti radioviļņu kvantu ģeneratori un redzamās gaismas kvantu ģeneratori - lāzeri. Lāzeri rada ļoti augstas jaudas koherentu starojumu. Lāzera starojumu ļoti plaši izmanto dažādās zinātnes un tehnikas jomās, piemēram, sakariem kosmosā, informācijas ierakstīšanai un glabāšanai (lāzerdiski) un metināšanai, medicīnā.
Spektri
Bora teorija ļāva izskaidrot līniju spektru esamību.
Formula (1) sniedz kvalitatīvu priekšstatu par to, kāpēc atomu emisijas un absorbcijas spektri ir sakārtoti. Faktiski atoms var izstarot tikai tādu frekvenču viļņus, kas atbilst enerģijas vērtību atšķirībām E 1 , E 2 , . . . , E n ,. . Tāpēc atomu emisijas spektru veido atsevišķi izvietotas asas spilgtas līnijas. Tajā pašā laikā atoms var absorbēt nevis jebkuru fotonu, bet tikai vienu ar enerģiju hν kas ir tieši vienāds ar starpību E n − Ek kādas divas atļautās enerģijas vērtības E n Un Ek. Pāreja uz augstākas enerģijas stāvokli E n, atomi absorbē tieši tos pašus fotonus, kurus tie spēj izstarot apgrieztās pārejas laikā uz sākotnējo stāvokli Ek. Vienkārši sakot, atomi no nepārtrauktā spektra ņem tās līnijas, kuras tie paši izstaro; Tāpēc aukstas atomgāzes absorbcijas spektra tumšās līnijas atrodas tieši tajās vietās, kur atrodas tās pašas gāzes emisijas spektra spilgtās līnijas sakarsētā stāvoklī.
Nepārtrauktā spektra ūdeņraža emisijas spektra ūdeņraža absorbcijas spektrs
Vārds "atoms" tulkojumā no grieķu valodas nozīmē "nedalāms". Ilgu laiku, līdz pat 20. gadsimta sākumam, atoms nozīmēja mazākās nedalāmās matērijas daļiņas. Līdz 20. gadsimta sākumam. Zinātne ir uzkrājusi daudzus faktus, kas norāda uz atomu sarežģīto uzbūvi.
Liels progress atomu struktūras izpētē tika panākts angļu zinātnieka Ernesta Raterforda eksperimentos par alfa daļiņu izkliedi, ejot cauri plāniem matērijas slāņiem. Šajos eksperimentos šaurs α daļiņu stars, ko izstaro radioaktīvā viela, tika novirzīts uz plānu zelta foliju. Aiz folijas tika novietots ekrāns, kas spēj spīdēt ātro daļiņu ietekmē. Tika konstatēts, ka lielākā daļa α-daļiņu novirzās no taisnas līnijas izplatīšanās pēc izlaišanas caur foliju, tas ir, tās ir izkliedētas, un dažas α-daļiņas parasti tiek izmestas atpakaļ. Razerfords α-daļiņu izkliedi skaidroja ar to, ka pozitīvais lādiņš lodītē ar rādiusu 10 -10 m nav vienmērīgi sadalīts, kā tika pieņemts iepriekš, bet gan koncentrējas atoma centrālajā daļā – atoma kodolā. Ejot garām kodolam, no tā tiek atgrūsta a-daļiņa ar pozitīvu lādiņu, un, atsitoties pret kodolu, tā tiek izmesta atpakaļ pretējā virzienā. Tā uzvedas daļiņas ar vienādu lādiņu, tāpēc ir centrālā pozitīvi lādētā atoma daļa, kurā koncentrējas ievērojama atoma masa. Aprēķini parādīja, ka, lai izskaidrotu eksperimentus, ir jāņem atoma kodola rādiuss aptuveni 10 -15 m.
Rezerfords ierosināja, ka atoms ir strukturēts kā planētu sistēma. Rezerforda atoma uzbūves modeļa būtība ir šāda: atoma centrā ir pozitīvi lādēts kodols, kurā ir koncentrēta visa masa, elektroni griežas ap kodolu apļveida orbītā lielos attālumos (kā planētas). ap Sauli). Kodola lādiņš sakrīt ar ķīmiskā elementa numuru periodiskajā tabulā.
h ir Planka konstante.
1. Vārds “atoms” tulkojumā no grieķu valodas nozīmē “nedalāms”. Ilgu laiku, līdz pat 20. gadsimta sākumam, atoms nozīmēja mazākās nedalāmās matērijas daļiņas. Līdz 20. gadsimta sākumam. Zinātne ir uzkrājusi daudzus faktus, kas norāda uz atomu sarežģīto uzbūvi.
Liels progress atomu struktūras izpētē tika panākts angļu zinātnieka Ernesta Raterforda eksperimentos par alfa daļiņu izkliedi, ejot cauri plāniem matērijas slāņiem. Šajos eksperimentos šaurs alfa daļiņu stars, ko izstaro radioaktīvā viela, tika novirzīts uz plānu zelta foliju. Aiz folijas tika novietots ekrāns, kas spēj spīdēt ātro daļiņu ietekmē. Tika konstatēts, ka lielākā daļa α-daļiņu novirzās no taisnās līnijas izplatīšanās pēc izlaišanas caur foliju, t.i., tās ir izkliedētas, un dažas α-daļiņas parasti tiek izmestas atpakaļ. Alfa daļiņu izkliedi Razerfords skaidroja ar to, ka pozitīvais lādiņš nav vienmērīgi sadalīts lodītē ar rādiusu 10^~10 m, kā tika pieņemts iepriekš, bet gan koncentrējas atoma centrālajā daļā – atoma kodolā. Ejot garām kodolam, no tā tiek atgrūsta a-daļiņa ar pozitīvu lādiņu, un, atsitoties pret kodolu, tā tiek izmesta atpakaļ pretējā virzienā. Tā uzvedas daļiņas ar vienādu lādiņu, tāpēc ir centrālā pozitīvi lādētā atoma daļa, kurā koncentrējas ievērojama atoma masa. Aprēķini parādīja, ka, lai izskaidrotu eksperimentus, ir jāņem atoma kodola rādiuss aptuveni 10^~15 m.
Rezerfords ierosināja, ka atoms ir strukturēts kā planētu sistēma. Rezerforda atoma uzbūves modeļa būtība ir šāda: atoma centrā ir pozitīvi lādēts kodols, kurā ir koncentrēta visa masa, elektroni griežas ap kodolu apļveida orbītā lielos attālumos (kā planētas). ap Sauli). Kodola lādiņš sakrīt ar ķīmiskā elementa numuru periodiskajā tabulā.
Rezerforda atoma uzbūves planetārais modelis nevarēja izskaidrot vairākus labi zināmus faktus: elektronam ar lādiņu Kulona pievilkšanās spēku dēļ jānokrīt uz kodolu, un atoms ir stabila sistēma; Pārvietojoties pa apļveida orbītu, tuvojoties kodolam, elektronam atomā ir jāizstaro visu iespējamo frekvenču elektromagnētiskie viļņi, t.i., izstarotajai gaismai jābūt ar nepārtrauktu spektru, taču praksē rezultāts ir atšķirīgs: atomu elektroni izstaro gaismu. kam ir līniju spektrs. Dāņu fiziķis Nīljē Bors bija pirmais, kurš mēģināja atrisināt pretrunas atomu struktūras planētu kodola modelī.
Bors savu teoriju balstīja uz diviem postulātiem. Pirmais postulāts: atomu sistēma var atrasties tikai īpašos stacionāros vai kvantu stāvokļos, no kuriem katram ir sava enerģija; stacionārā stāvoklī atoms neizstaro Tas nozīmē, ka elektrons (piemēram, ūdeņraža atomā) var atrasties vairākās precīzi noteiktās orbītās. Katra elektrona orbīta atbilst ļoti specifiskai enerģijai.
Otrais postulāts: pārejot no viena stacionāra stāvokļa uz otru, tiek emitēts vai absorbēts elektromagnētiskā starojuma kvants. Fotona enerģija ir vienāda ar starpību starp atoma enerģijām divos stāvokļos: , kur
h ir Planka konstante.
Kad elektrons pārvietojas no tuvumā esošās orbītas uz tālāku, atomu sistēma absorbē enerģijas kvantu. Kad elektrons pārvietojas no tālākas orbītas uz tuvāku orbītu attiecībā pret kodolu, atomu sistēma izstaro enerģijas kvantu.
Zinātnē ļoti ilgu laiku tika uzskatīts, ka atoms ir mazākā, NEDALĀMĀ matērijas daļiņa.
| 1. Pirmais, kas pārkāpa šīs idejas, bija Tomsons: viņš uzskatīja, ka atoms ir sava veida pozitīva viela, kurā elektroni ir iejaukti “kā rozīnes kūciņā”. Šīs teorijas nozīme ir tāda, ka atoms vairs netika atzīts par nedalāmu |  |
| 2. Rezerfords veica eksperimentu par alfa daļiņu izkliedi. Smagie elementi (zelta folija) tika bombardēti ar radioaktīvu materiālu. Rezerfords gaidīja, ka ieraudzīs kvēlojošus apļus, bet viņš ieraudzīja mirdzošus gredzenus. | |
| Rezerforda skaidrojums: atoma centrā ir viss pozitīvais lādiņš, un elektroniem nav nekādas ietekmes uz alfa daļiņu plūsmu. | |
| 3. Ūdeņraža atoma planetārais modelis pēc BORU | Izstarot enerģijas daļu (redzamu), atoms dod tikai savu viļņu garumu kopu – spektru. Spektru veidi: 1. Radiācijas (emisijas) spektrs: (nodrošina ķermeņi sakarsētā stāvoklī) a) Ciets - norādiet visus atomus cietās, šķidrās vai blīvās gāzēs b) Izklāta - dod atomus gāzveida stāvoklī 1. Absorbcijas spektrs: ja gaisma tiek izlaista caur vielu, tad šī viela absorbēs tieši tos viļņus, kurus tā izstaro sakarsētā stāvoklī (nepārtrauktā spektrā parādās tumšas svītras) Spektrālā analīze ir metode vielas ķīmiskā sastāva noteikšanai pēc tās emisijas vai absorbcijas spektra. Metodes pamatā ir fakts, ka katram ķīmiskajam elementam ir savs viļņu garumu kopums. Spektrālās analīzes pielietojums: kriminoloģijā, medicīnā, astrofizikā. Spektrogrāfs ir ierīce spektrālās analīzes veikšanai. Spektroskops atšķiras no spektrogrāfa ar to, ka to var izmantot ne tikai spektru novērošanai, bet arī spektra fotografēšanai. Biļete Nr.21 1. Termodinamiskā pieeja fizikālo parādību pētīšanai. Iekšējā enerģija un veidi, kā to mainīt. Pirmais termodinamikas likums. Pirmā termodinamikas likuma pielietojums izotermiskiem, izohoriskiem un adiabātiskajiem procesiem. 2. Atomu kodola uzbūves modeļi; kodolspēki; kodola nukleona modelis; kodolenerģija; kodolreakcijas. 1. Katram ķermenim ir ļoti specifiska struktūra, tas sastāv no daļiņām, kas haotiski kustas un mijiedarbojas savā starpā, tāpēc jebkuram ķermenim ir iekšējā enerģija. Iekšējā enerģija ir lielums, kas raksturo ķermeņa stāvokli, t.i., sistēmas mikrodaļiņu haotiskās (termiskās) kustības enerģija. (molekulas, atomi, elektroni, kodoli utt.) un šo daļiņu mijiedarbības enerģiju. Monatomiskās ideālās gāzes iekšējo enerģiju nosaka pēc formulas U = 3/2 t/M RT. Ķermeņa iekšējā enerģija var mainīties tikai tās mijiedarbības ar citiem ķermeņiem rezultātā. Ir divi veidi, kā mainīt iekšējo enerģiju: siltuma pārnese un mehāniskais darbs (piemēram, sildīšana berzes vai saspiešanas laikā, dzesēšana izplešanās laikā). Siltuma pārnese ir iekšējās enerģijas maiņa, neveicot darbu: enerģija tiek pārnesta no vairāk uzkarsētiem ķermeņiem uz mazāk apsildāmiem. Siltuma pārnese ir trīs veidu: siltumvadītspēja (tieša enerģijas apmaiņa starp mijiedarbībā esošo ķermeņu haotiski kustīgām daļiņām vai viena un tā paša ķermeņa daļām); konvekcija (enerģijas pārnešana ar šķidruma vai gāzes plūsmām) un starojums (enerģijas pārnešana ar elektromagnētiskajiem viļņiem). Pārnestās enerģijas mērs siltuma pārneses laikā ir siltuma daudzums (Q). Šīs metodes ir kvantitatīvi apvienotas enerģijas nezūdamības likumā, kas termiskajiem procesiem skan šādi: slēgtas sistēmas iekšējās enerģijas izmaiņas ir vienādas ar sistēmai nodotā siltuma daudzuma un ārējās enerģijas darba summu. spēki, kas tiek veikti sistēmai. , kur iekšējās enerģijas izmaiņas, Q ir sistēmai nodotā siltuma daudzums, A ir ārējo spēku darbs. Ja sistēma pati veic darbu, tad to parasti apzīmē ar A*. Tad siltuma procesu enerģijas nezūdamības likumu, ko sauc par pirmo termodinamikas likumu, var uzrakstīt šādi: , t.i. sistēmai nodotais siltuma daudzums tiek novirzīts sistēmas darba veikšanai un tās iekšējās enerģijas maiņai. Izobāriskās sildīšanas laikā gāze iedarbojas uz ārējiem spēkiem, kur V1 un V2 ir gāzes sākotnējais un galīgais tilpums. Ja process nav izobārs, darba apjomu var noteikt pēc ABCD skaitļa laukuma, kas atrodas starp līniju, kas izsaka atkarību p(V) un sākotnējo un beigu gāzes tilpumu V.
Apskatīsim pirmā termodinamikas likuma piemērošanu izoprocesiem, kas notiek ar ideālu gāzi. Izotermiskā procesā temperatūra ir nemainīga, tāpēc iekšējā enerģija nemainās. Tad termodinamikas pirmā likuma vienādojums iegūs šādu formu: , t.i., sistēmai nodotais siltuma daudzums aiziet darbu veikšanai izotermiskās izplešanās laikā, kādēļ temperatūra nemainās. Izobāriskā procesā gāze izplešas un gāzei nodotais siltuma daudzums aiziet tās iekšējās enerģijas palielināšanai un darbu veikšanai: . Izohoriskā procesa laikā gāze nemaina savu tilpumu, tāpēc ar to netiek veikts darbs, t.i., A = 0, un pirmā likuma vienādojumam ir forma , t.i., pārnestais siltuma daudzums iet, lai palielinātu iekšējo gāzes enerģija. Adiabātisks ir process, kas notiek bez siltuma apmaiņas ar vidi. Q = 0, tāpēc, gāzei izplešoties, tā darbojas, samazinot tās iekšējo enerģiju, tāpēc gāze atdziest.Līkni, kas attēlo adiabātisko procesu, sauc par adiabātisko. Jebkuras vielas atoma kodols sastāv no protoniem un neitroniem. (Protonu un neitronu vispārpieņemtais nosaukums ir nukleoni.) Protonu skaits ir vienāds ar kodola lādiņu un sakrīt ar elementa numuru periodiskajā tabulā. Protonu un neitronu skaita summa ir vienāda ar masas skaitli. Piemēram, skābekļa atoma kodols sastāv no 8 protoniem un 16 - 8 = 8 neitroniem. Atoma kodols sastāv no 92 protoniem un 235 - 92 = 143 neitroniem. Tiek saukti spēki, kas notur protonus un neitronus kodolā kodolspēki. Šis ir visspēcīgākais mijiedarbības veids. 1932. gadā angļu fiziķis Džeimss Čadviks atklāja daļiņas ar nulles elektrisko lādiņu un vienības masu. Šīs daļiņas sauca par neitroniem. Neitronu apzīmē ar n. Pēc neitrona atklāšanas fiziķi D. D. Ivanenko un V. Heisenbergs 1932. gadā izvirzīja atoma kodola protonu-neitronu modeli. Saskaņā ar šo modeli jebkuras vielas atoma kodols sastāv no protoniem un neitroniem. (Protonu un neitronu vispārpieņemtais nosaukums ir nukleoni.) Protonu skaits ir vienāds ar kodola lādiņu un sakrīt ar elementa numuru periodiskajā tabulā. Protonu un neitronu skaita summa ir vienāda ar masas skaitli. Piemēram, skābekļa atoma kodols sastāv no 8 protoniem un 16 - 8 = 8 neitroniem. Atoma kodols sastāv no 92 protoniem un 235 - 92 = 143 neitroniem. Ķīmiskās vielas, kas periodiskajā tabulā ieņem vienu un to pašu vietu, bet kurām ir atšķirīga atomu masa, sauc par izotopiem. Izotopu kodoli atšķiras ar neitronu skaitu. Piemēram, ūdeņradim ir trīs izotopi: protijs – kodols sastāv no viena protona, deitērijs – kodols sastāv no viena protona un viena neitrona, tritijs – kodols sastāv no viena protona un diviem neitroniem. Ja salīdzinām kodolu masas ar nukleonu masām, izrādās, ka smago elementu kodola masa ir lielāka par protonu un neitronu masu summu kodolā, bet vieglajiem elementiem - par kodola masu. ir mazāka par protonu un neitronu masu summu kodolā. Tāpēc pastāv masas atšķirība starp kodola masu un protonu un neitronu masu summu, ko sauc par masas defektu. M = Mn - (Mp + Mn). Tā kā starp masu un enerģiju pastāv saikne, tad smago kodolu skaldīšanas un vieglo kodolu sintēzes laikā ir jāatbrīvo enerģija, kas pastāv masas defekta dēļ, un šo enerģiju sauc par atoma kodola saistīšanas enerģiju. Šīs enerģijas izdalīšanās var notikt kodolreakciju laikā. Kodolreakcija ir kodola lādiņa un tā masas maiņas process, kas notiek kodola mijiedarbības laikā ar citiem kodoliem vai elementārdaļiņām. Kad notiek kodolreakcijas, tiek izpildīti elektrisko lādiņu un masas skaitļu saglabāšanas likumi: kodolreakcijā nonākušo kodolu un daļiņu lādiņu (masas skaitļu) summa ir vienāda ar lādiņu (masas skaitļu) summu. reakcijas galaprodukti (kodoli un daļiņas). Sadalīšanās ķēdes reakcija ir kodolreakcija, kurā daļiņas, kas izraisa reakciju, veidojas kā reakcijas produkti. Nepieciešams nosacījums ķēdes attīstībai |
1906. gads — E. Rezerfords veic eksperimentus, lai pārbaudītu Tomsona atomu modeļa konsistenci: Vakuumā, svina stiklā, atradās radioaktīvā starojuma avots (alfa daļiņas) – polonijs (Po).
Plānā zelta folija tika bombardēta ar pozitīvi lādētām alfa daļiņām, kuru ātrums bija aptuveni 20 000 km/s.
Ekrānā tika ierakstīti zibšņi no alfa daļiņām, kas to skāra.
Papildus galvenajam ekrānam alfa daļiņu pēdas tika ierakstītas arī sānu ekrānos. Zinot, kā līdzīgi uzlādētas daļiņas mijiedarbojas un kā tās atgrūž viena otru, mēs varam izskaidrot Rezerforda eksperimenta rezultātus:
Daļiņas, kas tika novirzītas, lidoja tuvu kodolam;
Atstarotās daļiņas precīzi trāpīja kodolam;
Daļiņas, kurām nebija novirzes, lidoja tālu no kodola.
83. jautājums. Kvantu teorija (Makss Planks).
Planks izteica ārkārtēju pieņēmumu: melnā ķermeņa starojums uz apkārtējo telpu tiek pārraidīts nevis nepārtraukti, bet gan atsevišķu mazu porciju veidā, ko viņš sauca par darbības kvantiem.
Cenšoties pārvarēt klasiskās teorijas grūtības izskaidrot melnā ķermeņa starojumu, M. Planks 1900. gadā izvirzīja hipotēzi: atomi izstaro elektromagnētisko enerģiju atsevišķās porcijās – kvantos. Enerģija E
Kur h=6,63,10-34 J.s-Planka konstante.
Dažreiz ir ērti izmērīt enerģiju un Planka konstanti elektronvoltos.
Tad h=4,136,10-15 eV.s. Atomu fizikā izmanto arī daudzumu
(1 eV ir enerģija, ko elementārs lādiņš iegūst, izejot cauri paātrinājuma potenciāla starpībai 1 V. 1 eV = 1,6,10-19 J).
Tādējādi M. Planks parādīja izeju no grūtībām, ar kurām saskārās termiskā starojuma teorija, pēc kuras sāka veidoties mūsdienu fizikālā teorija, t.s. kvantu fizika.
84. jautājums. Dzesēšanas šķidrumu savstarpējās kustības izvēle.
Dzesēšanas šķidrumu relatīvajai kustībai ir liela ietekme uz siltuma pārneses procesu. Dzesēšanas šķidrumu savstarpējai kustības virzienam ir iespējami šādi varianti: A). Uz priekšu plūsma B). Pretplūsma B). Šķērsstrāva D). Jaukta strāva
Dzesēšanas šķidrumu savstarpējā kustības virziena izvēle Tiešās plūsmas gadījumā mazāk uzkarsētā dzesēšanas šķidruma (dzesēšanas līdzekļa) galīgā temperatūra t2K nedrīkst pārsniegt vairāk uzkarsētā dzesēšanas šķidruma galīgo temperatūru t1K. Ar pretplūsmu tas ir iespējams. Lai process notiktu, ir jābūt zināmai temperatūras atšķirībai. Palielinoties t2K, dzesēšanas šķidruma patēriņš samazinās, t.i. no dzesēšanas šķidruma taupīšanas viedokļa ir vēlama pretplūsma.
Ja salīdzinām pretplūsmu un priekšplūsmu vienā un tajā pašā dzesēšanas šķidruma sākuma un beigu temperatūrā, tad ar pretplūsmu vidējais dzinējspēks ir lielāks, un dzesēšanas šķidruma plūsma ir vienāda. Siltuma pārneses ātrums ar pretplūsmu ir lielāks, tāpēc pretplūsma ir efektīvāka.
Tādējādi, veicot siltuma pārneses procesus, ir vēlams izmantot pretplūsmu. Tiešo plūsmu izmanto tikai tad, ja tā sniedz kādas tehnoloģiskas priekšrocības (piemēram, radot maigākus apkures apstākļus).
Ja kāds no dzesēšanas šķidrumiem maina savu agregācijas stāvokli, tad dzesēšanas šķidrumu relatīvajam kustības virzienam nav nozīmes.
85. jautājums. Gaismas izkliede. Normāla un anomāla izkliede. Gaismas fāzes un grupas ātrumi. Spektrālās ierīces.
Gaismas izkliede (gaismas sadalīšanās) ir parādība, ko izraisa vielas absolūtā laušanas koeficienta atkarība no gaismas frekvences (vai viļņa garuma) (frekvences dispersija) vai, tas pats, fāzes ātruma atkarība no gaismas. gaisma vielā uz viļņa garuma (vai frekvences). To eksperimentāli atklāja Ņūtons ap 1672. gadu, lai gan teorētiski diezgan labi izskaidrots daudz vēlāk.
Telpiskā izkliede ir vides dielektriskās konstantes tenzora atkarība no viļņu vektora. Šī atkarība izraisa vairākas parādības, ko sauc par telpiskās polarizācijas efektiem.
Viens no acīmredzamākajiem dispersijas piemēriem ir baltās gaismas sadalīšanās, kad tā iet caur prizmu (Ņūtona eksperiments). Izkliedes fenomena būtība ir dažāda viļņa garuma gaismas staru izplatīšanās fāzes ātrumu atšķirība caurspīdīgā vielā - optiskā vidē (kamēr vakuumā gaismas ātrums vienmēr ir vienāds neatkarīgi no viļņa garuma un līdz ar to arī krāsas ). Parasti, jo augstāka ir gaismas viļņa frekvence, jo augstāks ir tam paredzētās vides refrakcijas indekss un mazāks viļņa fāzes ātrums vidē:
Sarkanajai gaismai fāzes izplatīšanās ātrums vidē ir maksimālais, un refrakcijas pakāpe ir minimāla,
Violetai gaismai ir minimālais fāzes izplatīšanās ātrums vidē un maksimālā refrakcijas pakāpe.
Tomēr dažās vielās (piemēram, joda tvaikos) tiek novērots anomāls izkliedes efekts, kurā zilie stari laužas mazāk nekā sarkanie, bet citus starus viela absorbē un izvairās no novērošanas. Stingrāk sakot, anomālā izkliede ir plaši izplatīta, piemēram, gandrīz visās gāzēs tā ir novērojama frekvencēs pie absorbcijas līnijām, bet joda tvaikos tas ir diezgan ērti novērošanai optiskajā diapazonā, kur tie ļoti spēcīgi absorbē gaismu.
Gaismas izkliede ļāva pirmo reizi diezgan pārliecinoši demonstrēt baltās gaismas salikto raksturu.
Baltā gaisma sadalās spektrā, izejot cauri difrakcijas režģim vai atstarojot no tā (tas nav saistīts ar dispersijas fenomenu, bet gan izskaidrojams ar difrakcijas būtību). Difrakcijas un prizmatiskais spektrs ir nedaudz atšķirīgs: prizmatiskais spektrs ir saspiests sarkanajā daļā un izstiepts violetā un ir sakārtots dilstošā viļņa garuma secībā: no sarkanas līdz violetai; normāls (difrakcijas) spektrs ir vienāds visos apgabalos un ir sakārtots pieaugošā viļņu garuma secībā: no violetas līdz sarkanai.
Pēc analoģijas ar gaismas izkliedi līdzīgas parādības, kas saistītas ar jebkura cita rakstura viļņu izplatīšanās atkarību no viļņa garuma (vai frekvences), sauc arī par dispersiju. Šī iemesla dēļ, piemēram, termins dispersijas likums, kas tiek lietots kā kvantitatīvās attiecības nosaukums, kas savieno frekvenci un viļņa skaitli, attiecas ne tikai uz elektromagnētisko viļņu, bet uz jebkuru viļņu procesu.
Izkliede izskaidro faktu, ka pēc lietus parādās varavīksne (precīzāk, tas, ka varavīksne ir daudzkrāsaina, nevis balta).
Izkliede ir hromatisko aberāciju cēlonis - viena no optisko sistēmu aberācijām, tostarp foto un video objektīviem.
Augustins Košī ierosināja empīrisku formulu, lai tuvinātu vides refrakcijas indeksa atkarību no viļņa garuma:
kur ir viļņa garums vakuumā; a, b, c ir konstantes, kuru vērtības katram materiālam jānosaka eksperimentāli. Vairumā gadījumu varat aprobežoties ar pirmajiem diviem Košī formulas terminiem. Pēc tam tika piedāvātas citas precīzākas, bet tajā pašā laikā sarežģītākas tuvināšanas formulas.
Tātad gaismas dispersija ir vielas refrakcijas indeksa atkarība no gaismas viļņa frekvences. Šīs attiecības nav lineāras vai monotoniskas. ν vērtības reģioni, kuros
Atoms sastāv no kompakta un masīva pozitīvi lādēta kodola un negatīvi lādētiem gaismas elektroniem ap to.
Ernests Raterfords ir unikāls zinātnieks tādā nozīmē, ka viņš jau bija izdarījis savus galvenos atklājumus pēc saņemot Nobela prēmiju. 1911. gadā viņam izdevās eksperiments, kas ne tikai ļāva zinātniekiem dziļi ieskatīties atomā un gūt ieskatu tā struktūrā, bet arī kļuva par dizaina graciozitātes un dziļuma paraugu.
Izmantojot dabisku radioaktīvā starojuma avotu, Rezerfords uzbūvēja lielgabalu, kas radīja virzītu un fokusētu daļiņu plūsmu. Pistole bija svina kaste ar šauru spraugu, kuras iekšpusē tika ievietots radioaktīvais materiāls. Sakarā ar to svina ekrāns absorbēja daļiņas (šajā gadījumā alfa daļiņas, kas sastāv no diviem protoniem un diviem neitroniem), kuras radioaktīvā viela izstaro visos virzienos, izņemot vienu, un caur spraugu tika izlaists tikai vērsts alfa daļiņu stars. . Tālāk gar stara ceļu bija vēl vairāki svina sieti ar šaurām spraugām, kas nogrieza daļiņas, kas novirzās no stingri noteikta virziena. Rezultātā perfekti fokusēts alfa daļiņu stars lidoja uz mērķi, un pats mērķis bija plāna zelta folijas loksne. Tas bija alfa stars, kas viņu skāra. Pēc sadursmes ar folijas atomiem alfa daļiņas turpināja savu ceļu un atsitās pret luminiscējošu ekrānu, kas uzstādīts aiz mērķa, uz kura tika reģistrēti uzplaiksnījumi, kad alfa daļiņas tam atsitās. No tiem eksperimentētājs varēja spriest, kādā daudzumā un cik lielā mērā alfa daļiņas novirzās no taisnvirziena kustības virziena sadursmju ar folijas atomiem rezultātā.
Šāda veida eksperimenti ir veikti jau iepriekš. Viņu galvenā ideja bija uzkrāt pietiekami daudz informācijas no daļiņu novirzes leņķiem, lai varētu pateikt kaut ko noteiktu par atoma uzbūvi. Divdesmitā gadsimta sākumā zinātnieki jau zināja, ka atoms satur negatīvi lādētus elektronus. Tomēr dominēja ideja, ka atoms bija kaut kas līdzīgs pozitīvi lādētam smalkam režģim, kas piepildīts ar negatīvi lādētiem rozīņu elektroniem — modeli, ko sauc par "rozīņu režģa modeli". Pamatojoties uz šādu eksperimentu rezultātiem, zinātnieki varēja uzzināt dažas atomu īpašības - jo īpaši novērtēt to ģeometrisko izmēru secību.
Tomēr Razerfords atzīmēja, ka neviens no viņa priekšgājējiem pat nebija mēģinājis eksperimentāli pārbaudīt, vai dažas alfa daļiņas ir novirzītas ļoti lielos leņķos. Rozīņu režģa modelis vienkārši neļāva atomā būt tik blīviem un smagiem strukturāliem elementiem, ka tie varētu novirzīt ātrās alfa daļiņas ievērojamos leņķos, tāpēc neviens neuztraucās pārbaudīt šo iespēju. Rezerfords palūdza vienam no saviem studentiem pārkārtot instalāciju tā, lai būtu iespējams novērot alfa daļiņu izkliedi lielos novirzes leņķos - lai tikai notīrītu viņa sirdsapziņu, lai pilnībā izslēgtu šo iespēju. Detektors bija ekrāns, kas pārklāts ar nātrija sulfīdu, materiālu, kas rada fluorescējošu zibspuldzi, kad tam trāpa alfa daļiņa. Iedomājieties pārsteigumu ne tikai studentam, kurš tieši veica eksperimentu, bet arī pašam Raterfordam, kad izrādījās, ka dažas daļiņas ir novirzītas leņķī līdz 180°!
Izveidotā atoma modeļa ietvaros rezultātu nevarēja interpretēt: rozīņu režģī vienkārši nav nekā, kas varētu atspoguļot spēcīgu, ātru un smagu alfa daļiņu. Rezerfords bija spiests secināt, ka atomā lielākā masas daļa ir koncentrēta neticami blīvā vielā, kas atrodas atoma centrā. Un pārējā atoma daļa izrādījās daudzkārt mazāk blīva, nekā tika uzskatīts iepriekš. No izkliedēto alfa daļiņu uzvedības arī izrietēja, ka šajos superblīvajos atoma centros, kurus Raterfords nosauca serdeņi, ir koncentrēts arī viss atoma pozitīvais elektriskais lādiņš, jo tikai elektriskās atgrūšanās spēki var izraisīt daļiņu izkliedi leņķos, kas lielāki par 90°.
Gadus vēlāk Rezerfordam patika izmantot šo analoģiju par savu atklājumu. Kādā Āfrikas dienvidu valstī muitas amatpersonas tika brīdinātas, ka valstī kontrabandas ceļā tiks ievests liels nemierniekiem paredzēto ieroču krava, kas paslēpta kokvilnas ķīpās. Un tagad, pēc izkraušanas, muitas darbinieks saskaras ar veselu noliktavu, kas piepildīta ar kokvilnas ķīpām. Kā viņš var noteikt, kurās ķīpās ir šautenes? Muitnieks problēmu atrisināja vienkārši: viņš sāka šaut uz ķīpām, un, ja lodes rikošēja no kādas ķīpas, pēc šīs zīmes identificēja ķīpas ar kontrabandas ieročiem. Tātad Raterfords, redzot, kā alfa daļiņas rikošeta no zelta folijas, saprata, ka atoma iekšpusē ir paslēpta daudz blīvāka struktūra, nekā gaidīts.
Razerforda uzzīmētais atoma attēls, pamatojoties uz viņa eksperimenta rezultātiem, mums šodien ir labi zināms. Atoms sastāv no īpaši blīva, kompakta kodola, kas nes pozitīvu lādiņu, un negatīvi lādētiem gaismas elektroniem ap to. Vēlāk zinātnieki sniedza ticamu teorētisko pamatu šim attēlam ( cm. Bohr Atom), bet viss sākās ar vienkāršu eksperimentu ar nelielu radioaktīvā materiāla paraugu un zelta folijas gabalu.
Skatīt arī:
Ernests Razerfords, pirmais barons Raterfords no Nelsona, 1871-1937
Jaunzēlandes fiziķis. Dzimis Nelsonā, amatnieka zemnieka dēls. Ieguva stipendiju studijām Kembridžas Universitātē Anglijā. Pēc absolvēšanas viņš tika iecelts Kanādas Makgila universitātē, kur kopā ar Frederiku Sodiju (1877-1966) noteica radioaktivitātes fenomena pamatlikumus, par ko 1908. gadā viņam tika piešķirta Nobela prēmija ķīmijā. Drīz vien zinātnieks pārcēlās uz Mančestras Universitāti, kur viņa vadībā Hanss Geigers (1882-1945) izgudroja savu slaveno Geigera skaitītāju, sāka pētīt atoma uzbūvi un 1911. gadā atklāja atoma kodola esamību. Pirmā pasaules kara laikā viņš bija iesaistīts sonāru (akustisko radaru) izstrādē, lai atklātu ienaidnieka zemūdenes. 1919. gadā viņš tika iecelts par fizikas profesoru un Kembridžas universitātes Kavendiša laboratorijas direktoru, un tajā pašā gadā atklāja kodolieroču sabrukšanu augstas enerģijas smago daļiņu bombardēšanas rezultātā. Rezerfords palika šajā amatā līdz mūža beigām, vienlaikus ilgus gadus būdams Karaliskās zinātniskās biedrības prezidents. Viņš tika apglabāts Vestminsteras abatijā blakus Ņūtonam, Darvinam un Faradejam.
Jau senos laikos radās doma, ka Visums sastāv no mazām nedalāmām daļiņām – atomiem. Šī matērijas struktūras ideja saglabājās līdz 19. gadsimta beigām, kad līdz 20. gadsimta sākumam tika droši noteikts, ka katrs atoms satur elektronus. Prioritāte elektrona atklāšanā pieder angļu fiziķim J. Tomsonam. Tajā pašā laikā tolaik bija zināms, ka atoms ir elektriski neitrāls. Līdz ar to elektronu negatīvais lādiņš ir jākompensē ar atoma lādiņā iekļauto nezināmo daļiņu pozitīvo lādiņu.
19. gadsimta 90. gados plaši izplatījās Dž. Tomsona modelis par atomu viendabīgas, pozitīvas sfēriskas vides formā, kurā negatīvi lādēti elektroni ir izkliedēti kā rozīnes bulciņā. J. Tomsona atommodelis ir kā kēkss. Tomēr drīz vien “cupcake” modeļa autors ierosināja nestatisku elektronu stāvokli atomā.
Visreālākais šķita angļu fiziķa 1911. gadā piedāvātais E. Rezerforda atoma kodola jeb planētu modelis. Planētu modelis bija E. Raterforda un viņa kolēģu veikto eksperimentu rezultāts par alfa daļiņu izkliedi. Eksperimenti sastāvēja no sekojošā. Pozitīvi lādētu α daļiņu stars tiek novirzīts uz plānas folijas formas zelta loksnes. Aiz folijas atradās ekrāns, kas pārklāts ar scintilatoru - vielu, kas izstaro gaismu alfa daļiņas trieciena punktā. Pamatojoties uz Dž. Tomsona modeli, sagaidāms, ka α daļiņas netiks novirzītas lielos leņķos, jo elektroni ir daudz vieglāki nekā α daļiņas. Un patiešām eksperimenti parādīja, ka lielākā daļa alfa daļiņu brīvi izgāja caur folijas loksni, it kā tā būtībā būtu tukša vieta. Un tomēr dažas α daļiņas tika novirzītas nelielos leņķos, kas, kā varētu pieņemt, bija mijiedarbības sekas ar atoma pozitīvo lādiņu. Bet negaidīti un satriecoši bija tas, ka neliels skaits α daļiņu tika izkliedētas lielos leņķos, sasniedzot 180°. Tas varētu notikt tikai tad, ja pozitīvi lādētās α daļiņas izjustu atgrūšanos no masveida pozitīva lādiņa, kas koncentrēts nelielā telpas reģionā.
Pēc E. Rezerforda modeļa atoms sastāv no masīva, pozitīvi lādēta kodola, kurā ir koncentrēti 99,94% no atoma masas. Pozitīvā lādiņa lielumu novērtē ar reizinājumu ze, kur z ir ķīmiskā elementa atomskaitlis D. Mendeļejeva tabulā; e - elementārais lādiņš. Ap kodolu sfēras iekšpusē, kuras ārējais diametrs ir ~10 -10 m, slēgtās eliptiskās orbītās griežas z elektroni, veidojot atoma elektronu apvalku. Elektroni nevar atrasties miera stāvoklī atomā, jo šajā gadījumā Kulona piesaistes ietekmē tie nokristu uz kodolu. Pēc E. Rezerforda aplēsēm, kodola izmēriem jābūt 10 -15 -10 -14 m Salīdzinot kodola un atoma izmērus, mēs nonākam pie secinājuma, ka elektroniem jāatrodas no kodols atrodas par (10-100) 103 vairāk nekā kodola lielums. Un līdz ar to otrais secinājums: atoma lielākā daļa ir tukša telpa.
E. Rezerforda modeļa trūkums ir nespēja izskaidrot atoma izcilās stabilitātes faktu: pirmkārt, sadursmju laikā ar citiem atomiem; otrkārt, saskaņā ar klasiskās fizikas likumiem elektronu rotācija ap kodolu nevar būt stabila, jo tai ir jāpavada elektromagnētiskais starojums, tāpat kā jebkura paātrināta lādētu daļiņu kustība. Un saskaņā ar klasiskās fizikas likumiem elektroniem, kas pārvietojas pa apli, ir centripetālais paātrinājums. Centrpetālais spēks, kas notur elektronu orbītā ar rādiusu r, ir Kulona spēks, kas pievelk elektronu kodolam:
kur ε o = 8,85 10 -12 F/m - elektriskā konstante; m e - elektronu masa, kg; v ir elektrona ātrums orbītā, m/s. Elektromagnētiskā lauka radīšanai nepieciešama enerģija. Pakāpeniski jāsamazinās elektrona enerģijai un līdz ar to arī elektrona griešanās ātrumam ap kodolu. Galu galā elektronam jāiekrīt kodolā. Tomēr atomi ir diezgan stabili veidojumi un var pastāvēt miljardiem gadu. Treškārt, saskaņā ar E. Rezerforda modeli atoma emisijas spektram jābūt nepārtrauktam. Eksperimenti ir parādījuši, ka konkrēta atoma emisijas spektrs ir diskrēts.
Rezerforda pieredze.
Ernsts RETERFORDS (1871-1937), angļu fiziķis, viens no radioaktivitātes un atoma uzbūves doktrīnas pamatlicējiem, zinātniskās skolas dibinātājs, Krievijas Zinātņu akadēmijas ārvalstu korespondentloceklis (1922) un Krievijas Zinātņu akadēmijas goda loceklis. PSRS Zinātņu akadēmija (1925). Cavendish laboratorijas direktors (kopš 1919). Atklāja (1899) alfa un beta starus un noteica to būtību. Radīja (1903, kopā ar F. Sodiju) radioaktivitātes teoriju. Piedāvāja (1911) atoma planētu modeli. Veica (1919) pirmo mākslīgo kodolreakciju. Paredzēja (1921) neitrona esamību. Nobela prēmija (1908).Rezerforda eksperiments (1906) par ātri uzlādētu daļiņu izkliedi, kas iet caur plāniem matērijas slāņiem, ļāva izpētīt atomu iekšējo struktūru. Šajos eksperimentos alfa daļiņas tika izmantotas, lai pārbaudītu atomus - pilnībā jonizētus hēlija atomus -, kas radušies rādija un dažu citu elementu radioaktīvās sabrukšanas rezultātā. Rezerfords ar šīm daļiņām bombardēja smago metālu atomus.
Rezerfords zināja, ka atomi sastāv no vieglām negatīvi lādētām daļiņām – elektroniem un smagas pozitīvi lādētas daļiņas. Eksperimentu galvenais mērķis ir noskaidrot, kā pozitīvais lādiņš tiek sadalīts atoma iekšienē. α - daļiņu izkliedi (tas ir, kustības virziena izmaiņas) var izraisīt tikai pozitīvi lādētā atoma daļa.
Eksperimenti ir parādījuši, ka dažas α daļiņas ir izkliedētas lielos leņķos, tuvu 180˚, tas ir, tās tiek izmestas atpakaļ. Tas ir iespējams tikai tad, ja atoma pozitīvais lādiņš ir koncentrēts ļoti mazā atoma centrālajā daļā – atoma kodolā. Gandrīz visa atoma masa ir koncentrēta arī kodolā.
Izrādījās, ka dažādu atomu kodolu diametrs ir 10 -14 - 10 -15 cm, bet paša atoma izmērs ir ≈10 -8 cm, tas ir, 10 4 - 10 5 reizes lielāks par kodols.
Tādējādi atoms izrādījās “tukšs”.
Pamatojoties uz eksperimentiem par α-daļiņu izkliedi uz atomu kodoliem, Raterfords nonāca pie uz atoma planētu modeli. Saskaņā ar šo modeli atoms sastāv no maza pozitīvi lādēta kodola un elektroniem, kas riņķo ap to.
No klasiskās fizikas viedokļa šādam atomam jābūt nestabilam, jo elektroniem, kas pārvietojas orbītās ar paātrinājumu, nepārtraukti jāizstaro elektromagnētiskā enerģija.
Tālāku ideju attīstību par atomu uzbūvi veica N. Bors (1913), pamatojoties uz kvantu jēdzieniem.
Laboratorijas darbi.
Šo eksperimentu var veikt, izmantojot īpašu ierīci, kuras zīmējums ir parādīts 1. attēlā. Šī ierīce ir svina kaste ar pilnu vakuumu tajā un mikroskopu.

α-daļiņu izkliedi (kustības virziena maiņu) var izraisīt tikai pozitīvi lādētā atoma daļa. Tādējādi pēc α daļiņu izkliedes var noteikt pozitīvā lādiņa un masas sadalījuma raksturu atoma iekšienē. Rezerforda eksperimentu diagramma ir parādīta 1. attēlā. Radioaktīvo zāļu emitēto α-daļiņu stars tika atbrīvots ar diafragmu un pēc tam nokrita uz pētāmā materiāla (šajā gadījumā zelta) plānas folijas. Pēc izkliedes α-daļiņas nokrita uz sieta, kas pārklāts ar cinka sulfīdu. Katras daļiņas sadursme ar ekrānu tika pavadīta ar gaismas zibspuldzi (scintilāciju), ko varēja novērot caur mikroskopu.
Ar labu vakuumu ierīces iekšpusē un bez folijas ekrānā parādījās gaismas josla, kas sastāvēja no scintilācijām, ko izraisīja plāns α daļiņu stars. Bet, kad folija tika novietota staru kūļa ceļā, α-daļiņas izkliedes dēļ tika izplatītas lielākā ekrāna laukumā.
Mūsu eksperimentā ir jāizpēta α-daļiņa, kas, veidojot 180° leņķi, ir vērsta pret zelta serdi (2. att.) un jāuzrauga α-daļiņas reakcija, t.i. kādā minimālā attālumā α-daļiņa tuvosies zelta kodolam (3. att.).
 Rīsi. 2
Rīsi. 2
 3. att
3. att
Ņemot vērā:
V 0 =1,6*10 7 m/s – sākuma ātrums
d = 10 -13
r min =?
Jautājumi:
Kāds ir minimālais attālums r min starp α daļiņu un kodolu, ko var sasniegt šajā eksperimentā? (4. att.)
 4. att
4. att
Risinājums:
Mūsu eksperimentā α-daļiņa ir attēlota kā atoms
Z=2 – protoni
N= Au – Z = 4 – 2 = 2 neitroni
m p = Kilograms
Z=79 – protonu skaits
N= Au – Z = 196–79 = 117 (neitroni)

![]()
![]() Cl 2 /
H ∙m 2 – elektriskā konstante
Cl 2 /
H ∙m 2 – elektriskā konstante