1906. gadā Raterfords atklāja α daļiņu izkliedi. Rezerforda metode bija šāda. Ar rādiju C pārklāta stieple tika ievietota padziļinājumā svina gabalā. Virs stieples tika novietota šaura sprauga; α-daļiņas, kas iet caur šo spraugu, nokrita uz fotoplates. Tas viss tika ievietots misiņa cilindrā, no kura tika izsūknēts gaiss. Cilindrs tika novietots starp elektromagnēta poliem, kura spēka līnijas bija paralēli stieplei. Iegūtās svītras uz fotoplāksnes bija krasi ierobežotas tukšumā. Ja cilindrs bija piepildīts ar gaisu, tad svītras bija platākas un to malas bija izplūdušas. Ja spraugu pārklāj ar plānu kādas vielas kārtiņu, svītras kļūst platākas un to intensitāte pamazām samazinās no centra uz malām.
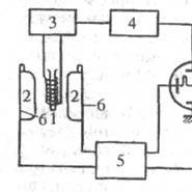
1909.-1910.gadā G. Geigers rūpīgi pētīja α-daļiņu izkliedi, izmantojot scintilācijas metodi. Geigera ierīce ir parādīta attēlā, kas ņemts no Ģēģera raksta, 1910. Radons tiek ievadīts koniskā caurulē L, noslēgts ar plānu vizlas kārtu un paliek tajā vairākas stundas. Tad radons tiek iesūkts traukā B, un drīz pēc tam visas a-daļiņas tiek izmestas ar rādiju: C, kas nogulsnējas uz caurules sieniņām. Sprauga D no rādija C izstarotās α-daļiņu plūsmas izvēlas šauru staru kūli, kas sniedz spilgtu scintilāciju attēlu uz cinka sulfīda ekrāna S. Ja pēc tam E tiek ievietota plāna pētāmās vielas plāksne, scintilācijas ekrāns ir samazināts α-daļiņu izkliedes dēļ. Eksperimenta rezultāti ir attēloti ar līknēm, kur izkliedes leņķi ir attēloti pa abscisu asi, bet daļiņu skaits, kas izkliedētas noteiktā leņķī, ir attēlots pa ordinātu asi. No Ģēģera eksperimentiem izriet, ka:
- Visticamākais izkliedes leņķis (t.i., leņķis, kurā ir vislielākais izkliedēto daļiņu skaits) palielinās maziem biezumiem aptuveni proporcionāli α-daļiņu caurdurtās vielas biezuma kvadrātsaknei. Lielākiem biezumiem izkliede palielinās daudz ātrāk.
- Visticamākais leņķis, kādā daļiņa tiek novirzīta, ejot cauri atomam, ir proporcionāls atoma svaram. Šī leņķa faktiskā vērtība zelta atoma gadījumā ir aptuveni 1/200 grādu.
- Visticamākais izkliedes leņķis strauji palielinās, samazinoties α-daļiņu ātrumam, kas pēc pirmās tuvināšanas ir apgriezti proporcionāls ātruma kubam.
Visspilgtākā parādība, kas novērota α daļiņu izkliedes laikā, bija fakts, kas atklāts 1909. gadā. Ģēģers Un Marsden, ka neliela daļiņu daļa ir izkliedēta ļoti lielos leņķos tā, ka daļiņas lido atpakaļ uz avotu. Alfa daļiņām, ko emitē rādijs C, aptuveni viena no 8000 daļiņām ir izkliedēta leņķī, kas ir lielāks par taisno leņķi.

Kā izskaidrot šo faktu? Pieņemot, ka atomam ir piedāvātā struktūra D. D. Tomsons, tad α daļiņas atsevišķas novirzes pēc sadursmes ar šādu atomu ir ļoti mazas, un lielus izkliedes leņķus var interpretēt kā kumulatīvu efektu, kas izriet no daudzām novirzēm. Pašu Tomsona un Rezerforda veiktie aprēķini parādīja, ka pat ar lielāku sadursmju skaitu α daļiņas novirzei vajadzētu būt ļoti mazai. “Esmu parādījis,” rakstīja Raterfords 1914. gadā, “ka lorda Kelvina piedāvātais un sera D. D. Tomsona ļoti detalizēti izstrādātais atoma modelis nevar dot tik lielas novirzes, ja vien pozitīvās sfēras diametrs netiek pieņemts kā ārkārtīgi mazs. ”.
Nepieciešamība interpretēt Geigera un Marsdena eksperimentu rezultātus noveda Rezerfordu pie atoma kodolmodeli. Viņš pirmo reizi ziņoja par savu atklājumu rakstā “α- un β-staru izkliede un atoma struktūra”, kas tika lasīts Mančestras Filozofijas biedrībā 1911. gada 7. martā. Mēs sniedzam šo vēstījumu pilnībā, ņemot vērā tā milzīgo vēsturisko nozīmi. nozīme.
"Ir labi zināms, ka α- un β-daļiņas novirzīsies no saviem taisnajiem ceļiem sadursmē ar vielas atomiem. β-daļiņu izkliede to mazā momenta (t.i., impulsa - P.K.) un enerģijas dēļ kopumā ir daudz lielāka, nekā α daļiņu novirze. Šķiet droši, ka šīs strauji kustīgās daļiņas iziet cauri atomu sistēmai, un detalizētai radušos novirzes izpētei vajadzētu atklāt atoma elektrisko struktūru. Parasti tiek pieņemts, ka novērotā izkliede ir daudzu mazu izkliedes rezultāts.Kungs D. D. Tomsons (Proc. Camb. Phil. Soc. 15, 5. lpp., 1910) nesen attīstīja mazo izkliedes teoriju, un galvenie teorijas secinājumi tika eksperimentāli pārbaudīti Grouter (Proc. Roy. Soc. 84, 226. lpp., 1910). Saskaņā ar šo teoriju tiek pieņemts, ka atoms sastāv no pozitīvi elektrificētas sfēras, kas satur vienādu daudzumu negatīvās elektrības asinsķermenīšu veidā. Salīdzinot teoriju ar eksperimentu, Grouter secināja, ka asinsķermenīšu skaits atomā ir aptuveni trīs reizes lielāks par tā atoma svaru, kas izteikts ūdeņraža svarā. Tomēr ir vairāki izkliedes eksperimenti, kas parāda, ka α un β daļiņas dažkārt piedzīvo novirzes, kas pārsniedz 90° vienā sadursmē. Piemēram, Geigers un Marsdens (Proc. Roy. Soc. 82, 493. lpp., 1909) atklāja, ka neliela daļa α-daļiņu, kas nokrīt uz plānas zelta lapas, piedzīvo novirzi, kas ir lielāka par taisnu leņķi. Tik liela novirze nav izskaidrojama ar varbūtību teoriju, ņemot vērā eksperimentāli novēroto mazo izkliedi. Protams, šķiet, ka šīs lielās novirzes notiek vienā atomu sadursmē.
Lai izskaidrotu šos un citus rezultātus, jāpieņem, ka elektrificētās daļiņas atomā iziet cauri intensīvam elektriskajam laukam. Lādētu daļiņu izkliedi var izskaidrot, pieņemot, ka atoms sastāv no centrālā elektriskā lādiņa, kas koncentrēts kādā punktā un ko ieskauj vienāds vienāda lieluma pretējās elektrības sfēriskais sadalījums. Ar šādu atoma izvietojumu α- un β-daļiņas, kad tās šķērso tuvu attālumam no atoma centra, piedzīvo lielas novirzes, lai gan lielas novirzes iespējamība ir maza. Saskaņā ar šo teoriju, daļu no kopējā uzlādēto daļiņu skaita, kurām ir novirze starp leņķiem Ф un Ф+dФ, nosaka izteiksme

kur n ir atomu skaits uz izkliedējošā materiāla tilpuma vienību, t ir pieņemtais materiāla mazais biezums un ![]() kur Ne ir lādiņš atoma centrā, E ir elektrificētās daļiņas lādiņš, m ir tās masa un u ir tās ātrums.
kur Ne ir lādiņš atoma centrā, E ir elektrificētās daļiņas lādiņš, m ir tās masa un u ir tās ātrums.
No tā izriet, ka izkliedēto daļiņu skaits laukuma vienībā nemainīgā attālumā no staru kūļa krišanas punkta mainās kā cosec 4 Ф / 2. Šo sadalījuma likumu eksperimentāli pārbaudīja Geigers attiecībā uz α-daļiņām, un tika konstatēts, ka derīgs eksperimentālo kļūdu robežās.
Apspriežot dažādu materiālu izkliedes vispārīgos rezultātus, tika konstatēts, ka atoma centrālais lādiņš ir ļoti proporcionāls tā atoma svaram. Precīzs centrālā kodola lādiņš nav noteikts, bet zelta atomam tas ir aptuveni 100 lādiņa vienības.
Šādā klasiski skaidrā un kodolīgā formā pasaule uzzināja par vienu no lielākajiem atklājumiem zinātnes vēsturē.
Divus gadus vēlāk Rezerfords grāmatā “Radioaktīvās vielas un to starojums” sīkāk aprakstīja savu un līdzstrādnieku darbu, kura rezultātā tika atklāts atoma kodolmodelis.
Šeit ir aprēķini, kas ļauj noteikt α-daļiņu skaitu, kas izkliedētas leņķī φ pret staru kūļa sākotnējo virzienu:

kur n ir atomu skaits izkliedējošās vielas tilpuma vienībā, t ir izkliedējošās plāksnes biezums, Q ir α-daļiņu skaits, kas krīt uz izkliedējošās plāksnes laukuma vienību, r ir attālums no avota uz ekrānu, b ir vērtība, ko nosaka vienādība

kur Ne ir izkliedējošā kodola lādiņš, E ir α-daļiņas lādiņš, m ir tās masa, V ir ātrums.
Rezerforda likums ļauj ne tikai pārbaudīt atoma kodolstruktūras hipotēzes pamatotību, bet arī noteikt kodola lādiņu (Ne). Ģēģers nekavējoties sāka to izmēģināt tajā pašā 1911. gadā. Eksperiments apstiprināja cosec 4 φ / 2 likuma derīgumu un norādīja, ka lādiņa lielums ir aptuveni proporcionāls atoma svaram. 1913. gadā Geigers un Marsdens veica jaunu eksperimentālu Raterforda formulas testu, izmantojot scintilācijas metodi. "Tas bija ļoti grūts un rūpīgs darbs," rakstīja Raterfords, "jo bija jāsaskaita daudzi tūkstoši daļiņu. Geigera un Marsdena rezultāti ļoti cieši sakrīt ar teoriju."
Šeit ir daži dati no Geigera un Marsden.
Mainoties ātrumam V un citiem nemainīgiem parametriem, Raterforda formula dod, ka yV 4 = const. Geigera-Marsdena dati:
>
1/V 4 (relatīvā vērtība) 1,0 1,21 1,50 1,91 2,84 4,32 9,22
Leņķa atkarībai Rezerforda formula dod

Pēc Ģēģera un Marsdena domām,

Un visbeidzot, attiecībā uz atkarību no lādiņa (Ne), Rezerforda formula dod attiecību v" / A 2 noturību, kur A ir atomu svars, v" = v / nt - "samazināts scintilāciju skaits". Pēc Ģēģera un Marsdena domām,

"Geigers un Marsdens atklāja," norāda Rezerfords, "ka vielas izkliede pa dažādiem atomiem ir aptuveni proporcionāla atoma svara kvadrātam, no kā izriet, ka atoma lādiņš ir aptuveni proporcionāls atoma svaram. Noskaidrojuši ar plānām zelta kārtiņām izkaisīto α daļiņu skaitu, viņi secināja, ka kodola lādiņš ir aptuveni vienāds ar pusi no atoma svara, kas reizināts ar elektrona lādiņu. Eksperimenta grūtību dēļ reālo skaitu varēja noteikt tikai ar ar precizitāti, kas nepārsniedz 20%.
“Tādējādi,” Raterfords nobeidz savu prezentāciju par Geigera un Marsdena eksperimentu rezultātiem, “Ģēģera un Marsdena eksperimentālie rezultāti izrādījās pilnīgi saskanīgi ar teorijas prognozēm un norādīja, ka manis izvirzītā hipotēze par struktūru. atoms ir pareizs savās vienkāršākajās pazīmēs. Interesanti atzīmēt, ka tālajā 1913. gadā Rezerfords pieņēma kodola lādiņu kā vienādu ar +Ne, t.i., viņš pieļāva gan pozitīvā, gan negatīvā kodola lādiņa iespēju. Patiešām, novirzes mehānika pieļauj gan pozitīvu, gan negatīvu atoma lādiņu. Bet vairāki fakti, un jo īpaši D. D. Tomsona pētījumi ar pozitīvajiem stariem, par kuriem mēs drīz runāsim, ir parādījuši, ka pozitīvās elektrības nesēji vienmēr ir saistīti ar masu, kas ir lielāka vai vienāda ar ūdeņraža atoma masu. Masīvs kodols var nest tikai pozitīvus lādiņus. Tiesa, jau 1913. gadā Bors nonāca pie secinājuma, ka kodolā obligāti jābūt arī elektroniem. Šo hipotēzi pirmo reizi izteica Marija Sklodovska-Kirī. Jebkurā gadījumā līdz 1913. gadam beidzot tika noskaidrota saistība starp kodola lādiņu un elementa kārtas numuru periodiskajā tabulā (van den Broek, Moseley).
Klasiskus eksperimentus atoma struktūras izpētei veica sers Ernests Raterfords 1911. gadā. Rezerfords veica eksperimentus, lai pētītu alfa daļiņu izkliedi ar plānām metāla folijas loksnēm. Ietekme uz atomiem tika veikta, bombardējot tos ar masīvu daļiņu staru. Eksperimentālā diagramma ir parādīta attēlā. 1.
Plānā zelta folija F (folijas biezums bija aptuveni 10-7 m, uz tās bija novietoti ap 400 atomi) tika ievietota sfēriskā ekrāna E iekšpusē. Caur caurumu ekrānā radioaktīvā viela izstaro ātru alfa daļiņu staru. zāles, kas atrodas svina traukā, nokrita perpendikulāri uz plāksnes R. Alfa daļiņas ir pilnībā jonizēts hēlija atoms ar masu, kas vienāda ar 4,0015 amu. un maksa vienāda ar + 2e
 (e ir elementārā elektriskā lādiņa vērtība). Alfa daļiņas ātrums bija 10 7 m/s, enerģija bija 4,05 MeV. Kad folijas biezums ir mazs, alfa daļiņu sadursme ir gandrīz viena, t.i. katra daļiņa saduras tikai ar vienu atomu, mainot lidojuma virzienu.
(e ir elementārā elektriskā lādiņa vērtība). Alfa daļiņas ātrums bija 10 7 m/s, enerģija bija 4,05 MeV. Kad folijas biezums ir mazs, alfa daļiņu sadursme ir gandrīz viena, t.i. katra daļiņa saduras tikai ar vienu atomu, mainot lidojuma virzienu.
Ekrāna iekšējās sienas bija pārklātas ar fosforu, vielu, kurā uzplaiksnījumi notika vietās, kur skāra alfa daļiņas. Tas ļāva reģistrēt alfa daļiņas ar M ierīci, kas izkliedētas pa atomiem dažādos leņķos θ no sākotnējā virziena. Eksperimenti ar alfa daļiņu izkliedi ļāva noteikt šādus modeļus.
1. Lielākā daļa alfa daļiņu gandrīz brīvi iziet cauri folijai: tās netiek novirzītas un nezaudē enerģiju.
2. Tikai neliela daļiņu daļa (≈ 0,01%, tas ir, viena desmittūkstošā daļa) pagriezās atpakaļ, tas ir, mainīja kustības virzienu par leņķi, kas lielāks par 90 grādiem.
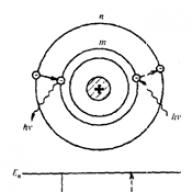
Rezerforda eksperimentu rezultātus var izskaidrot, balstoties uz pieņēmumu, ka viss pozitīvais lādiņš un gandrīz visa atoma masa ir koncentrēta nelielā atoma apgabalā - kodolā, kura izmēri ir aptuveni 10 -14 m. lādēti elektroni pārvietojas ap kodolu milzīgā (salīdzinājumā ar kodolu) apgabalā, kura izmērs ir aptuveni 10 -10 m.
Šis pieņēmums ir pamatā atoma kodolmodelis, ko sauc arī par planetāro. Elektronu skaits atomā ir vienāds ar elementa atomu skaitu Mendeļejeva periodiskajā tabulā. Turklāt tika parādīts, ka spēki, kas savieno elektronus ar kodolu, ir pakļauti Kulona likumam.
Tomēr kodolmodelis ir pretrunā ar klasiskās elektrodinamikas likumiem. Faktiski, ja elektrons atrodas miera stāvoklī atomā, tam Kulona pievilkšanas spēka ietekmē jānokrīt uz kodolu. Ja elektrons riņķo ap kodolu, tam vajadzētu izstarot elektromagnētisko lauku. Tajā pašā laikā tas zaudē savu enerģiju starojuma ietekmē, kustības ātrums samazinās, un elektronam galu galā jānokrīt uz kodolu. Atomu emisijas spektriem šajā gadījumā jābūt nepārtrauktiem, un atoma kalpošanas laiks nedrīkst pārsniegt 10-7 s. Faktiski atomi ir stabili, un atomu emisijas spektri ir diskrēti.
Fizikas stunda 11. klasē
Temats:
"Raterforda alfa daļiņu izkliedes eksperiments"
Nodarbības mērķi un uzdevumi:
Izglītības:
Izskaidrojiet Rezerforda eksperimentu mehānismu
Izglītības:
attīstīt studentu kognitīvo neatkarību;
veicināt viņu morālo un estētisko izglītību.
Izglītības:
Attīstīt spēju izcelt galveno, būtisko, salīdzināt pētāmos faktus un loģiski izteikt domas.
Nodarbību laikā:
es.Org. brīdis.
Stāviet tieši blakus savam rakstāmgaldam un sakopieties. Pasveicini skolotāju. Pēc tam mierīgi sēdiet savā vietā un uzturiet kārtību klasē.
Nodarbības tēmas un mērķa noteikšana.
II. Atkārtojums
Līniju spektri
1.Ko nozīmē vārds atoms?2.Kurš zinātnieks atklāja ķīmisko elementu īpašību periodiskas atkārtošanās likumu?
3.Vai atoms ir nedalāms?
4. Kas notiek ar retinātām gāzēm, kad tās uzkarsē līdz augstai temperatūrai?
5. Kā sauc daudzkrāsainas līnijas, kas atdalītas ar tumšām atstarpēm?
6. Kas ir raksturīgs katrai gāzei?
7. Kurai gāzei ir visvienkāršākais spektrs?
8. Kurš gāzes spektrs sastāv no 4 līnijām?
9. Kurš zinātnieks izvēlējās redzamā apgabala spektrālo līniju formulu?
10. Kura teorija ļāva apvienot redzamā, ultravioletā un infrasarkanā apgabala formulas vienā vispārīgā formulā?
Fizminutka saskaņā ar video.
III. Jauns materiāls
§ 7.2. Rezerforda eksperiments par alfa daļiņu izkliedi.
Pētot alfa daļiņu izkliedi, kad tās iet cauri zelta folijai,ErnestsRezerfords nonāca pie secinājuma, ka viss atomu pozitīvais lādiņš ir koncentrēts to centrā ļoti masīvā un kompaktā kodolā. Un ap šo kodolu griežas negatīvi lādētas daļiņas (elektroni).

Šis modelis būtiski atšķīrās no Tomsona atoma modeļa, kas tajā laikā bija plaši izplatīts.

Džozefs DžonsTomsons ierosināja atoma modeli pudiņa (pīrāga) formā, kurā pozitīvs lādiņš vienmērīgi aizpildīja visu atoma tilpumu un ar to bija mijas elektroni.

Nedaudz vēlāk Rezerforda modelis tika saukts par atoma planētu modeli (tas patiešām ir līdzīgs Saules sistēmai: smagais kodols ir Saule, un ap to riņķojošie elektroni ir planētas).
1912. gadā E. Rezerfords un viņa līdzstrādnieki veica eksperimentu par alfa daļiņu izkliedi vielā.

Rezerforda eksperimentu shēma.
Ja nebija folijas, uz ekrāna parādījās spilgts aplis, kas sastāvēja no scintilācijām, ko izraisīja plāns alfa daļiņu stars. Bet, kad alfa daļiņu ceļā tika novietota plāna zelta folija, kuras biezums bija aptuveni 0,1 μm (mikrons), ekrānā redzamais attēls ievērojami mainījās: atsevišķi uzplaiksnījumi parādījās ne tikai ārpus iepriekšējā apļa, bet tie pat varēja būt novērota no zelta folijas pretējās puses.
Saskaitot scintilāciju skaitu laika vienībā dažādās ekrāna vietās, ir iespējams noteikt izkliedēto alfa daļiņu sadalījumu telpā. Alfa daļiņu skaits strauji samazinās, palielinoties izkliedes leņķim.
Ekrānā novērotais attēls lika secināt, ka lielākā daļa alfa daļiņu iziet cauri zelta folijai, nemainot to kustības virzienu. Tomēr dažas daļiņas lielos leņķos novirzījās no sākotnējā alfa daļiņu virziena (apmēram 135 o...150 o ) un pat tika izmesti atpakaļ. Pētījumi liecina, ka, alfa daļiņām izejot cauri folijai, uz katriem 10 000 krītošajām daļiņām tikai viena tiek novirzīta ar leņķi, kas lielāks par 10 O no sākotnējā kustības virziena. Tikai kā retu izņēmumu viena no milzīgā alfa daļiņu skaita novirzās no sākotnējā virziena.
Fakts, ka daudzas alfa daļiņas izgāja cauri folijai, nenovirzoties no to kustības virziena, liecina, ka atoms nav cieta vienība. Tā kā alfa daļiņas masa ir gandrīz 8000 reižu lielāka par elektrona masu, folijas atomos iekļautie elektroni nevar manāmi mainīt alfa daļiņas. Alfa daļiņu izkliedi var izraisīt pozitīvi lādēta atoma daļiņa - atoma kodols.
IV.Pastiprinājums
Piemēru izskatīšana.
V. Atspulgs
Vai jums patika mūsu šodienas nodarbība?.. Ko tu atceries?...
VI. D/Z atkārto §7.1, mācies §7.2
Ernests Raterfords ir viens no atoma iekšējās struktūras pamatdoktrīnas dibinātājiem. Zinātnieks dzimis Anglijā, imigrantu ģimenē no Skotijas. Rezerfords bija ceturtais bērns savā ģimenē un izrādījās vistalantīgākais. Viņam izdevās dot īpašu ieguldījumu atomu struktūras teorijā.
Sākotnējās idejas par atoma uzbūvi
Jāpiebilst, ka pirms tika veikts slavenais Rezerforda eksperiments par alfa daļiņu izkliedi, tolaik dominējošā ideja par atoma uzbūvi bija Tompsona modelis. Šis zinātnieks bija pārliecināts, ka pozitīvais lādiņš vienmērīgi aizpilda visu atoma tilpumu. Tompsons uzskatīja, ka negatīvi lādēti elektroni ir it kā sajaukti ar to.

Zinātniskās revolūcijas priekšnoteikumi
Pēc skolas beigšanas Raterfords kā talantīgākais students saņēma 50 mārciņu stipendiju tālākizglītībai. Pateicoties tam, viņš varēja doties uz koledžu Jaunzēlandē. Pēc tam jaunais zinātnieks nokārto eksāmenus Kenterberijas Universitātē un sāk nopietni studēt fiziku un ķīmiju. 1891. gadā Raterfords teica savu pirmo runu par tēmu "Elementu evolūcija". Pirmo reizi vēsturē tas izklāstīja ideju, ka atomi ir sarežģītas struktūras.
Tajā laikā zinātnieku aprindās dominēja Daltona ideja, ka atomi ir nedalāmi. Visiem Rezerforda apkārtējiem viņa ideja šķita pilnīgi neprātīga. Jaunajam zinātniekam bija pastāvīgi jāatvainojas saviem kolēģiem par savām "muļķībām". Bet pēc 12 gadiem Rezerfordam tomēr izdevās pierādīt, ka viņam ir taisnība. Rezerfordam bija iespēja turpināt pētījumus Kavendišas laboratorijā Anglijā, kur viņš sāka pētīt gaisa jonizācijas procesus. Rezerforda pirmais atklājums bija alfa un beta stari.

Rezerforda pieredze
Atklājumu īsumā var raksturot šādi: 1912. gadā Raterfords kopā ar saviem palīgiem veica savu slaveno eksperimentu – no svina avota tika emitētas alfa daļiņas. Visas daļiņas, izņemot tās, kuras absorbēja svins, pārvietojās pa uzstādīto kanālu. Viņu šaurā straume nokrita uz plānas folijas kārtas. Šī līnija bija perpendikulāra lapai. Rezerforda eksperiments par alfa daļiņu izkliedi pierādīja, ka daļiņas, kas izgāja tieši caur folijas loksni, izraisīja tā sauktās scintilācijas uz ekrāna.
Šis ekrāns tika pārklāts ar īpašu vielu, kas sāka spīdēt, kad tam skāra alfa daļiņas. Telpa starp zelta folijas slāni un ekrānu tika piepildīta ar vakuumu, lai novērstu alfa daļiņu izkliedi gaisā. Šāda ierīce ļāva pētniekiem novērot daļiņas, kas izkliedējas aptuveni 150° leņķī.
Ja folija netika izmantota kā šķērslis alfa daļiņu stara priekšā, tad uz ekrāna izveidojās viegls scintilāciju aplis. Bet, tiklīdz viņu sijas priekšā tika novietota zelta folijas barjera, aina ļoti mainījās. Zibspuldzes parādījās ne tikai ārpus šī apļa, bet arī folijas pretējā pusē. Rezerforda eksperiments par alfa daļiņu izkliedi parādīja, ka lielākā daļa daļiņu izgāja cauri folijai bez manāmām izmaiņām to trajektorijā.
Šajā gadījumā dažas daļiņas tika novirzītas diezgan lielā leņķī un pat tika izmestas atpakaļ. Uz katriem 10 000 daļiņām, kas brīvi šķērsoja zelta folijas slāni, tikai viena tika novirzīta ar leņķi, kas pārsniedza 10° - izņēmuma gadījumā viena no daļiņām tika novirzīta ar šādu leņķi.

Iemesls, kāpēc alfa daļiņas tika novirzītas
Tas, ko Rezerforda eksperiments detalizēti pārbaudīja un pierādīja, ir atoma struktūra. Šī situācija norādīja, ka atoms nav nepārtraukts veidojums. Lielākā daļa daļiņu brīvi izgāja cauri viena atoma biezajai folijai. Un tā kā alfa daļiņas masa ir gandrīz 8000 reižu lielāka nekā elektrona masa, pēdējais nevarēja būtiski ietekmēt alfa daļiņas trajektoriju. To varēja izdarīt tikai atoma kodols - maza izmēra ķermenis, kam ir gandrīz visa atoma masa un viss elektriskais lādiņš. Toreiz tas kļuva par nozīmīgu izrāvienu angļu fiziķim. Rezerforda pieredze tiek uzskatīta par vienu no svarīgākajiem soļiem atoma iekšējās uzbūves zinātnes attīstībā.
Citi atklājumi, kas veikti atoma izpētes procesā
Šie pētījumi sniedza tiešus pierādījumus tam, ka atoma pozitīvais lādiņš atrodas tā kodolā. Šī zona aizņem ļoti mazu vietu salīdzinājumā ar tās kopējiem izmēriem. Tik mazā tilpumā alfa daļiņu izkliede izrādījās ļoti maz ticama. Un tās daļiņas, kas gāja garām atoma kodola apgabalam, piedzīvoja krasas novirzes no trajektorijas, jo atgrūšanas spēki starp alfa daļiņu un atoma kodolu bija ļoti spēcīgi. Rezerforda alfa daļiņu izkliedes eksperiments pierādīja iespējamību, ka alfa daļiņa nonāks tieši pret kodolu. Tiesa, varbūtība bija ļoti maza, bet tomēr ne nulle.
Tas nebija vienīgais fakts, ko pierādīja Rezerforda pieredze. Atoma struktūru īsi pētīja viņa kolēģi, kuri veica vairākus citus svarīgus atklājumus. Izņemot mācību, ka alfa daļiņas ir ātri kustīgi hēlija kodoli.
Zinātnieks spēja aprakstīt atoma struktūru, kurā kodols aizņem nelielu daļu no kopējā tilpuma. Viņa eksperimenti pierādīja, ka gandrīz viss atoma lādiņš ir koncentrēts tā kodolā. Šajā gadījumā notiek gan alfa daļiņu novirzes gadījumi, gan to sadursmes gadījumi ar kodolu.

Rezerforda eksperimenti: atoma kodolmodelis
1911. gadā Raterfords pēc daudziem pētījumiem ierosināja atoma struktūras modeli, ko viņš sauca par planetāro. Saskaņā ar šo modeli atoma iekšpusē atrodas kodols, kas satur gandrīz visu daļiņas masu. Elektroni pārvietojas ap kodolu līdzīgi tam, kā planētas pārvietojas ap Sauli. No to kombinācijas veidojas tā sauktais elektronu mākonis. Kā parādīja Rezerforda eksperiments, atomam ir neitrāls lādiņš.
Atoma struktūra vēlāk ieinteresēja zinātnieku Nīlss Bors. Tieši viņš pabeidza Rezerforda mācību, jo pirms Bora atoma planetārais modelis sāka saskarties ar izskaidrošanas grūtībām. Tā kā elektrons pārvietojas ap kodolu noteiktā orbītā ar paātrinājumu, agrāk vai vēlāk tam jānokrīt uz atoma kodolu. Tomēr Nīls Bors spēja pierādīt, ka atoma iekšienē klasiskās mehānikas likumi vairs nav spēkā.
Secinājumi no Raterforda alfa daļiņu izkliedes eksperimenta: 1. Ir atoma kodols, t.i. neliels ķermenis, kurā ir koncentrēta gandrīz visa atoma masa un viss pozitīvais lādiņš. 2. Gandrīz visa atoma masa ir koncentrēta kodolā. 3. Negatīvās daļiņas - elektroni - griežas ap kodolu slēgtās orbītās. 4. Visu elektronu negatīvais lādiņš ir sadalīts pa visu atoma tilpumu. Atomu kodolmodelis:
9. slaids no prezentācijas "Raterforda eksperiments, atoma modelis". Arhīva izmērs ar prezentāciju ir 174 KB.Fizika 9. klase
citu prezentāciju kopsavilkums"Elementa atoma struktūra" - kurš atklāja radioaktivitātes fenomenu. Struktūra. Atoms ir "nedalāms". Rezerfords veica vairākus eksperimentus, lai izpētītu atomu struktūru un sastāvu. Tomsons ierosināja vienu no pirmajiem atoma struktūras modeļiem 1903. gadā. Anrī Bekerels atklāj radioaktivitātes fenomenu. Daļiņa izraisīja uzplaiksnījumu ekrānā. Divi notikumi 19. gadsimta beigās radīja ideju par sarežģītu atomu struktūru. Atoma struktūra. Planētu (kodolmodelis).
"Mākoņu kamera" - ierīces mērķis. Robota princips. Uzlabošana. Jauda. Ierīces izgudrotājs. Nozīme. Kamera. Vilsons. Vilsona kamera. Ierīce.
“Kodolenerģijas drošība” - no kodolenerģijas vēstures. Urāna kodolu sabrukšanas reakcija. Verdoša kodolreaktora darbības shēma. Drošība. Verdoša kodolreaktora diagramma. Atomelektrostacijām ir lielākas iespējas enerģijas ražošanā. Atomelektrostacijas. Kodolenerģijas kaitējums. Atomelektrostacijas Krievijas kartē. Kodolreaktors. Kodolenerģija. Termiskā kodolsintēze. Kodolenerģijas ieguvumi un kaitējums. Kodolledlauži.
“Fizika “Kustība”” - Ķermeņu mijiedarbība. Mehānika. Saglabāšanās likums mehānikā. Atoma struktūra. Ķermeņu inerce un masa. Ātrums nevienmērīgas kustības laikā. Kā mainās koordinātas. Kustība taisnas, vienmērīgi paātrinātas kustības laikā. Dinamikas pamati. Spēka darbs. Ņūtona 2. likums. Ķermeņu brīvais kritiens. Fizikas pamati. Matērijas īpašību izpēte. Vektors. Ņūtona 3. likums. Aprites periods un biežums. Paātrinājums. Fizika ir precīza zinātne.
“Matemātiskā svārsta svārstības” - Nodarbības plāns. Svārsta svārstību praktiska izmantošana. Galilejs Galilejs (1564-1642). Huigenss Kristiāns (1629 – 1695). Jebkurš ķermenis var veikt svārstīgas kustības. Eksperiments tika veikts šaurā lokā. Mehānisko vibrāciju ilustrācija, izmantojot Fuko svārsta piemēru. Vecā Pizas universitātes ēka. Īstu svārstu var uzskatīt par matemātisko, ja vītnes garums ir daudz lielāks par uz tā piekārtā ķermeņa izmēru.
“Pirmais kosmiskais ātrums” - atrisiniet problēmas. Brīvā kritiena paātrinājums. Ātrums, kas jāpiešķir ķermenim, lai tas kļūtu par satelītu. Ievads mākslīgajos pavadoņos. Pirmais bēgšanas ātrums. Nosacījumi, kādos ķermenis kļūst par mākslīgo intelektu. Mākslīgie Zemes pavadoņi. Nosakiet pirmo evakuācijas ātrumu satelīta palaišanai. Atrisiniet problēmu. Planētu revolūcija ap Sauli.